Методический материал является подробной инструкцией к порядку выполнения практических работ по школьному курсу химии. Материал содержит тему работы, цель, краткое теоретическое обоснование темы, подробное описание проводимых экспериментов, порядок оформления результатов и формулировки выводов. Может применяться как инструктивная карточка – практикум.
Учитель химии МБОУ Митрофановской СОШ Зябкина О.А.
«Решение экспериментальных задач» (образец оформления работы)
Практическая работа
П р и м е ч а н и е . Проводится при обобщении и контроле знаний и умений
обучающихся и требует от них максимальной самостоятельности.
Ц е л и : учиться экспериментальным путем различать вещества, определять
их свойства, проводить химические эксперименты по плану, анализировать
результаты и оформлять отчет.
П л а н р а б о т ы :
1. Определить реактивы для опыта 1 и составить уравнения реакций.
2. Вспомнить химические свойства веществ и определить необходимый
реактив для опыта 2.
3. Определить реактивы для опыта 3 и составить схему описанных
превращений.
4. Определить правила ТБ.
О б о р у д о в а н и е и р е а к т и в ы :
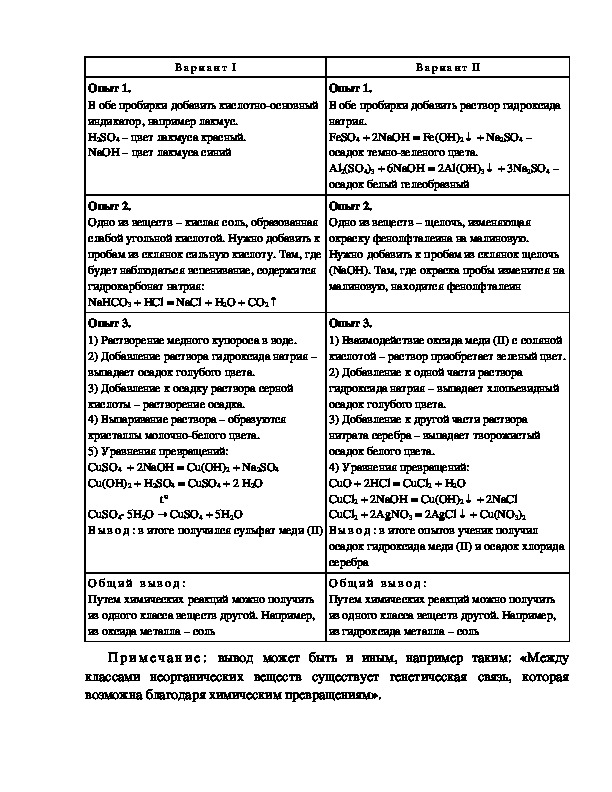
В а р и а н т I
В а р и а н т II
Штатив с пробирками, спиртовка, зажим
пробирочный (или лабораторный штатив),
фарфоровая чашка для выпаривания; 2
пробирки – с растворами серной кислоты и
гидроксида натрия; кислотноосновный
индикатор (лакмус), 2 пронумерованные
пробирки – с растворами борной кислоты и
гидрокарбоната натрия; растворы соляной
кислоты, гидроксида натрия
Штатив с пробирками; 2 пробирки –
с растворами сульфата железа (II) и сульфата
алюминия; 2 пронумерованные пробирки – с
растворами гидроксида калия и
фенолфталеином; растворы гидроксида
натрия, нитрата серебра, соляной кислоты
ТБ: аккуратно работать с химическими реактивами и лабораторным
оборудованием, не пробовать и не нюхать вещества, применять правила работы
со спиртовкой и правила нагревания и выпаривания веществ.
Х о д р а б о т ы
Отчет о результатах опытов заносится в таблицу, где представлены
алгоритмы их проведения.В а р и а н т I
В а р и а н т II
Опыт 1.
В обе пробирки добавить кислотноосновный
индикатор, например лакмус.
H2SO4 – цвет лакмуса красный.
NaOH – цвет лакмуса синий
Опыт 2.
Одно из веществ – кислая соль, образованная
слабой угольной кислотой. Нужно добавить к
пробам из склянок сильную кислоту. Там, где
будет наблюдаться вспенивание, содержится
гидрокарбонат натрия:
NaHCO3 + НСl = NaCl + H2O + CO2↑
Опыт 3.
1) Растворение медного купороса в воде.
2) Добавление раствора гидроксида натрия –
выпадает осадок голубого цвета.
3) Добавление к осадку раствора серной
кислоты – растворение осадка.
4) Выпаривание раствора – образуются
кристаллы молочнобелого цвета.
5) Уравнения превращений:
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Cu(OH)2 + H2SO4 = CuSO4 + 2 H2O
t°
→
CuSO4∙ 5H2O
В ы в о д : в итоге получился сульфат меди (II)
4 + 5H2O
CuSO
О б щ и й в ы в о д :
Путем химических реакций можно получить
из одного класса веществ другой. Например,
из оксида металла – соль
+ Na
2SO4 –
Опыт 1.
В обе пробирки добавить раствор гидроксида
натрия.
↓
FeSO4 + 2NaOH = Fe(OH)2
осадок темнозеленого цвета.
Al2(SO4)3 + 6NaOH = 2Al(OH)3
осадок белый гелеобразный
Опыт 2.
Одно из веществ – щелочь, изменяющая
окраску фенолфталеина на малиновую.
Нужно добавить к пробам из склянок щелочь
(NaOH). Там, где окраска пробы изменится на
малиновую, находится фенолфталеин
↓
+ 3Na
2SO4 –
Опыт 3.
1) Взаимодействие оксида меди (II) c соляной
кислотой – раствор приобретает зеленый цвет.
2) Добавление к одной части раствора
гидроксида натрия – выпадает хлопьевидный
осадок голубого цвета.
3) Добавление к другой части раствора
нитрата серебра – выпадает творожистый
осадок белого цвета.
4) Уравнения превращений:
CuO + 2HCl = CuCl2 + H2O
↓
CuCl2 + 2NaOH = Cu(OH)2
+ 2NaCl
↓
CuCl2 + 2AgNO3 = 2AgCl
+ Cu(NO
В ы в о д : в итоге опытов ученик получил
осадок гидроксида меди (II) и осадок хлорида
серебра
О б щ и й в ы в о д :
Путем химических реакций можно получить
из одного класса веществ другой. Например,
из гидроксида металла – соль
3)2
П р и м е ч а н и е : вывод может быть и иным, например таким: «Между
классами неорганических веществ существует генетическая связь, которая
возможна благодаря химическим превращениям».