
Государственное бюджетное профессиональное образовательное учреждение «Чебаркульский профессиональный техникум»
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
ПО ВЫПОЛНЕНИЮ ПРАКТИЧЕСКИХ РАБОТ
Специальность 22.02.05 Обработка металлов давлением (на базовом уровне)
Дисциплина ОУДБ.07 Химия
Курс обучения - 1
Форма обучения - очная
Чебаркуль, 2018 г.
|
Рассмотрено и одобрено на заседании цикловой комиссии ЕНД Протокол № __ от ________20__г. Председатель ЦК ______ Кудрявцева Т.А. |
Составлено в соответствии с программой по дисциплине «Химия» |
Разработчик Долгих Ю.П.
СОДЕРЖАНИЕ
1. Пояснительная записка
2. Перечень практических работ
3. Инструктивно-методические указания по выполнению практических работ
Лабораторная работа №1
Лабораторная работа №2
Лабораторная работа №3
Практическое занятие №4
Лабораторная работа №5
Лабораторная работа №6
Лабораторная работа №7
Лабораторная работа №8
Лабораторная работа № 9
Лабораторная работа №10
Практическое занятие № 11
Практическое занятие № 12
Лабораторная работа №13
Лабораторная работа №14
Лабораторная работа № 15
Лабораторная работа № 16
Практическое занятие № 17
Практическое занятие № 18
4. Литература, информационное обеспечение
5. Критерии оценивания лабораторных и практических работ
1. Пояснительная записка
Методические рекомендации предназначены в качестве методического пособия при проведении практических работ (занятий), (далее - занятий) по дисциплине «Химия» для специальности СПО 22.02.05 Обработка металлов давлением.
Практические работы проводятся после изучения соответствующих разделов и тем учебной дисциплины. Выполнение обучающимися практических работ позволяет им понять, где и когда изучаемые теоретические положения и практические умения могут быть использованы в будущей практической деятельности.
Целью практических работ является закрепление теоретических знаний и приобретение практических умений и навыков:
- получение веществ;
- демонстрация характерных реакций веществ;
- идентификация веществ и т.д.
Описания практических работ содержат:
-наименование работы;
-цель работы;
-дидактическое оснащение;
-краткие теоретические сведения;
-порядок проведения работы (инструкция), контрольные вопросы по данной работе;
-форма выполнения отчета.
В результате выполнения практических занятий по дисциплине Химия обучающиеся должны достигать следующих результатов:
- чувство гордости и уважения к истории и достижениям отечественной химической науки; химически грамотное поведение в профессиональной деятельности и в быту при обращении с химическими веществами, материалами и процессами;
- готовность к продолжению образования и повышения квалификации в избранной профессиональной деятельности и объективное осознание роли химических компетенций в этом;
- умение использовать достижения современной химической науки и химических технологий для повышения собственного интеллектуального развития в выбранной профессиональной деятельности;
- использование различных видов познавательной деятельности и основных интеллектуальных операций (постановки задачи, формулирования гипотез, анализа и синтеза, сравнения, обобщения, систематизации, выявления причинно-следственных связей, поиска аналогов, формулирования выводов) для решения поставленной задачи, применение основных методов познания (наблюдения, научного эксперимента) для изучения различных сторон химических объектов и процессов, с которыми возникает необходимость сталкиваться в профессиональной сфере;
- использование различных источников для получения химической информации, умение оценить ее достоверность для достижения хороших результатов в профессиональной сфере;
- сформированность представлений о месте химии в современной научной картине мира; понимание роли химии в формировании кругозора и функциональной грамотности человека для решения практических задач;
- владение основополагающими химическими понятиями, теориями, законами и закономерностями; уверенное пользование химической терминологией и символикой;
- владение основными методами научного познания, используемыми в химии: наблюдением, описанием, измерением, экспериментом; умение обрабатывать, объяснять результаты проведенных опытов и делать выводы; готовность и способность применять методы познания при решении практических задач;
- сформированность умения давать количественные оценки и производить расчеты по химическим формулам и уравнениям;
- владение правилами техники безопасности при использовании химических веществ;
- сформированность собственной позиции по отношению к химической информации, получаемой из разных источников.
Методические рекомендации могут быть использованы для самостоятельной работы обучающихся.
2. Перечень практических занятий по специальности:
22.02.05 Обработка металлов давлением.
|
№ п/п |
Наименование темы |
Вид работы (ПЗ (ЛР)), № Наименование работы |
Количество часов |
|
1 |
Периодический закон и Периодическая система химических элементов Д.И.Менделеева и строение атома |
Лабораторная работа №1 Моделирование построения Периодической таблицы химических элементов |
1 |
|
2 |
Строение вещества |
Лабораторная работа №2 Приготовление суспензии карбоната кальция в воде. Получение эмульсии моторного масла |
1 |
|
3 |
Строение вещества |
Лабораторная работа №3 Ознакомление со свойствами дисперсных систем |
1 |
|
4 |
Вода. Растворы. Электролитическая диссоциация |
Практическое занятие №4 Приготовление раствора заданной концентрации
|
1 |
|
5 |
Классификация неорганических соединений и их свойства |
Лабораторная работа №5 Испытание растворов кислот индикаторами. Взаимодействие металлов с кислотами. Взаимодействие кислот с оксидами металлов. Взаимодействие кислот с основаниями. Взаимодействие кислот с солями |
1 |
|
6 |
Классификация неорганических соединений и их свойства |
Лабораторная работа №6 Испытание растворов щелочей индикаторами. Взаимодействие щелочей с солями. Разложение нерастворимых оснований |
1 |
|
7 |
Классификация неорганических соединений и их свойства |
Лабораторная работа №7 Взаимодействие солей с металлами. Взаимодействие солей друг с другом. Гидролиз солей различного типа
|
1 |
|
8 |
Химические реакции |
Лабораторная работа №8 Реакция замещения меди железом в растворе медного купороса. Реакции, идущие с образованием осадка, газа или воды |
1 |
|
9 |
Химические реакции |
Лабораторная работа №9 Зависимость скорости взаимодействия соляной кислоты с металлами от их природы. Зависимость скорости взаимодействия цинка с соляной кислотой от ее концентрации. Зависимость скорости взаимодействия оксида меди (II) с серной кислотой от температуры
|
1 |
|
10 |
Металлы и неметаллы |
Лабораторная работа №10 Закалка и отпуск стали. Ознакомление со структурами серого и белого чугуна. Распознавание руд железа |
1 |
|
11 |
Металлы и неметаллы |
Практическое занятие № 11 Получение, собирание и распознавание газов |
1 |
|
12 |
Металлы и неметаллы |
Практическое занятие № 12 Решение экспериментальных задач |
1 |
|
13 |
Основные понятия органической химии и теория строения органических соединений |
Лабораторная работа №13 Изготовление моделей молекул органических веществ |
1 |
|
14 |
Углеводороды и их природные источники |
Лабораторная работа №14 Ознакомление с коллекцией образцов нефти и продуктов ее переработки. Ознакомление с коллекцией каучуков и образцами изделий из резины |
1 |
|
15 |
Кислородосодержащие органические соединения |
Лабораторная работа № 15 Растворение глицерина в воде и взаимодействие с гидроксидом меди (II). Свойства уксусной кислоты, общие со свойствами минеральных кислот. Доказательство непредельного характера жидкого жира. Взаимодействие глюкозы и сахарозы с гидроксидом меди (II). Качественная реакция на крахмал.
|
1 |
|
16 |
Азотосодержащие органические соединения. Полимеры |
Лабораторная работа № 16 Растворение белков в воде. Обнаружение белков в молоке и мясном бульоне. Денатурация раствора белка куриного яйца спиртом, растворами солей тяжелых металлов и при нагревании.
|
1 |
|
17 |
Азотосодержащие органические соединения. Полимеры |
Практическое занятие № 17 Решение экспериментальных задач на идентификацию органических соединений
|
1 |
|
18 |
Азотосодержащие органические соединения. Полимеры |
Практическое занятие № 18 Распознавание пластмасс и волокон |
1 |
|
|
Итого |
|
18 ч |
3. Инструктивно-методические указания по выполнению практических работ
Лабораторная работа №1
Наименование работы: Моделирование построения Периодической таблицы химических элементов
Цель работы: изучение s, p,d, f элементов на основании их положения в Периодической системе, моделирование Периодической системы.
Продолжительность работы – 1 ч.
Дидактическое оснащение: Периодическая система химических элементов Д.И. Менделеева, рисунки строения s, p,d, f элементов.
Задание
1.Выявить закономерность Периодической системы и сформулировать ее в виде закона.
2.Написать электронную формулу атома кислорода, магния и фосфора.
3.К каким элементам они относятся и где располагаются в Периодической таблице Д.И. Менделеева?
4.Какое максимальное количество электронов может находиться в IV периоде таблицы Д.И. Менделеева?
Краткие теоретические сведения
Строение s, p,d, f элементов и их положение в Периодической системе.
Существует 4 типа орбиталей :s, p,d, f .
s – орбитали имеют сферическую форму;
p- орбитали имеют форму гантели;
d – орбитали имеют форму листа клевера;
f – орбитали – форму шести лепестного цветка.
Каждую орбиталь могут занимать 2 электрона. Следовательно, максимальное число электронов, которые могут находиться на первом уровне равно двум.
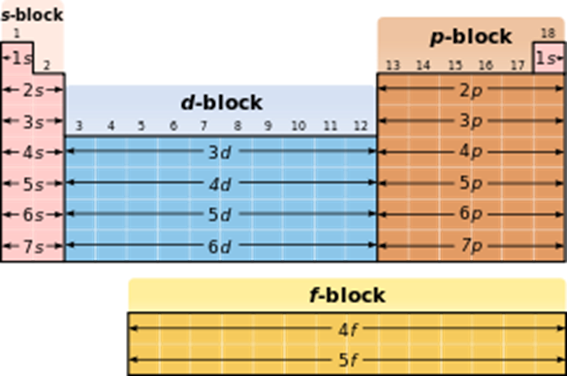
N=2 n2 , где n-номер энергетического уровня, N-максимальное число электронов на этом уровне. На втором -8 ( 2 – на s – орбитали и 6 на р-орбитали). На третьем - 18 электронов (2 на s, 6 на р, 10 на d и 14 на f). В зависимости от того, на какую орбиталь отправлен последний электрон, химические элементы можно разделить на семейства (блоки): s, p,d, f .
К s-элементам относятся элементы I и II групп главных подгрупп, а также гелий.
К р- элементам относятся элементы III и VIII групп главных подгрупп.
К d- элементам относятся элементы побочных подгрупп.
К f - элементам относятся лантаноиды и актиноиды.
Деление Периодической таблицы на блоки.
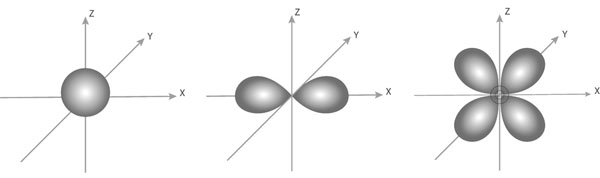
s- облако р-облако d -облако
Порядок работы
1. Внимательно прочитать главу «Краткие теоретические сведения»;
2. Выполнить предложенные задания;
3. Оформить отчет;
4. Ответить на контрольные вопросы.
Содержание отчета: укажите номер лабораторного опыта, тему, цель, оборудование, выполните задания методических указаний, сформулируйте и запишите вывод.
Контрольные вопросы
1.Кем был открыт Периодический закон?
2.Как изменилась формулировка Периодического закона по мере развития науки?
3.В чем физический смысл: а) порядкового номера элемента; б) номера периода; в) номера группы?
4.Почему водород занимает в Периодической системе двойственное положение?
5.Названия, каких из химических элементов в таблице Д.И. Менделеева связаны с Россией и русскими?
Продолжительность работы – 1 ч.
Задание
1.Получите дисперсную систему: суспензию карбоната кальция в воде.
2. Получите дисперсную систему: эмульсию моторного масла.
Порядок работы
1.Навеску около 2 г мела измельчить в фарфоровой ступке до порошкообразного состояния так, чтобы размеры частиц были не более 1мм, и не образовалась излишне тонкая пыль.
2.На электронных весах взять навеску мела массой 1г и высыпать в коническую колбу.
3.Цилиндром отмерить 25 мл воды.
4.Смешать порошок и воду в колбе, тщательно перемешивая в течение 3 мин.
5.К маслу в пробирке добавьте 1-2 мл воды и энергично взболтайте.
5.Опишите наблюдаемые явления:
|
Опыт |
Что наблюдали |
Вывод
|
|
1. |
|
|
Содержание отчета: укажите номер лабораторного опыта, тему, цель, оборудование, выполните задания методических указаний, сформулируйте и запишите вывод.
3.Каково значение суспензии в повседневной жизни?
Лабораторная работа №3
Наименование работы: Ознакомление со свойствами дисперсных систем
Цель работы: изучить компонентный состав различных естественных и искусственных дисперсных систем.
Продолжительность работы – 1 ч.
Дидактическое оснащение: примеры дисперсных систем.
Задание
1.Ознакомиться со свойствами дисперсных систем.
Краткие теоретические сведения
Чистые
вещества в природе встречаются очень редко, чаще всего встречаются смеси. Смеси
разных веществ в различных агрегатных состояниях могут образовывать гомогенные (растворы)
и гетерогенные (дисперсные) системы.
Дисперсными - называют гетерогенные системы, в которых одно вещество
- дисперсная фаза ( их может быть несколько) в виде очень
мелких частиц равномерно распределено в объеме другого - дисперсионной
среде.
Среда и фазы находятся в разных агрегатных состояниях – твердом, жидком и
газообразном. По величине частиц веществ, составляющих дисперсную фазу,
дисперсные системы делятся 2 группы :
- Грубодисперсные (взвеси) с размерами частиц более 100 нм. Это непрозрачные системы, в которых фаза и среда легко разделяются отстаиванием или фильтрованием. Это- эмульсии , суспензии , аэрозоли.
- Тонкодисперсные- с
размерами частиц от 100 до 1 нм . Фаза и среда в таких системах отстаиванием
разделяются с трудом. Это: золи (коллоидные растворы - "клееподобные"
) и гели(студни).
Коллоидные системы прозрачны и внешне похожи на истинные растворы,
но отличаются от последних по образующейся “светящейся дорожке” – конусу при
пропускании через них луча света. Это явление называют эффектом Тиндаля.
При определенных условиях в коллоидном растворе может начаться процесс
коагуляции.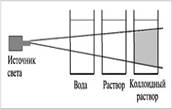
Коагуляция –
явление слипания коллоидных частиц и выпадения их в осадок . При этом
коллоидный раствор превращается в суспензию или гель. Гели или студни представляют
собой студенистые осадки, образующиеся при коагуляции золей. Со временем
структура гелей нарушается (отслаивается) – из них выделяется вода. Это
явление синерезиса.
Различают 8 типов дисперсных систем (д/с + д/ф)
· Г+Ж→ аэрозоль (туман, облака, карбюраторная смесь бензина с воздухом в ДВС)
· Г+ТВ→ аэрозоль (дым, смог, пыль в воздухе)
· Ж+Г→ пена (газированные напитки, взбитые сливки)
· Ж+Ж→ эмульсия (молоко, майонез, плазма крови, лимфа, цитоплазма)
· Ж+ТВ→ золь, суспензия (речной и морской ил, строительные растворы, пасты)
· ТВ+Г→ твердая пена (керамика, пенопласт, поролон, полиуретан, пористый шоколад)
· ТВ+Ж→ гель (желе, желатин, косметические и медицинские мази, помада)
· ТВ+ТВ→ твердый золь (горные породы, цветные стекла).
Дисперсной называется гетерогенная (неоднородная) система, в которой одно вещество в виде очень мелких частиц относительно равномерно распределено в объеме другого.
Дисперсная фаза – это вещество, которое присутствует в меньшем количестве и распределяется в объеме другого.
Дисперсионная среда - это вещество, которое присутствует в большем количестве и в объеме которого распределяется другое вещество.
Организмы животных и растений, гидросфера, земная кора и недра, космическое пространство часто представляют собой вещества в раздробленном, или, как говорят, дисперсном, состоянии. Большинство веществ окружающего нас мира существует в виде дисперсных систем: почвы, ткани живых организмов, пищевые продукты и др. Химия дисперсного состояния довольно новая наука
Дисперсная система — это образования из двух или более фаз (тел), которые совершенно или практически не смешиваются и не реагируют друг с другом химически. Первое из веществ (дисперсная фаза) мелко распределено во втором (дисперсионная среда). Если фаз несколько, их можно отделить друг от друга физическим способом (центрифугировать, сепарировать и т. д.). Наиболее общая классификация дисперсных систем основана на различии в агрегатном состоянии дисперсионной среды и дисперсной фазы. Сочетания трех видов агрегатного состояния позволяют выделить девять видов дисперсных систем. Для краткости записи их принято обозначать дробью, числитель которой указывает на дисперсную фазу, а знаменатель на дисперсионную среду, например для системы «газ в жидкости» принято обозначение Г/Ж.
Порядок работы
1.Перепишите в тетрадь из приведенного текста определения понятий: Дисперсная система, Дисперсная фаза, Дисперсная среда.
2.Перечертите таблицу в тетрадь и заполните графу «Примеры природных и бытовых дисперсных систем», используя прилагаемый список.
Таблица «Примеры природных и бытовых дисперсных систем»
|
Дисперсионная среда |
Дисперсная фаза |
Примеры природных и бытовых дисперсных систем |
|
Газ |
Газ |
|
|
Жидкость |
|
|
|
Твердое вещество |
|
|
|
Жидкость |
Газ |
|
|
Жидкость |
|
|
|
Твердое вещество |
|
|
|
Твердое веществ |
Газ |
|
|
Жидкость |
|
|
|
Твердое вещество |
|
Список дисперсных систем: воздух, природный газ, туман, карбюраторная смесь в двигателях автомобиля, аэрозоль в баллончике, пыль в воздухе, дым, смог, песчаная буря, пыльная буря, шипучие напитки, пена, плазма крови, пищеварительные соки, цитоплазма клеток, кисель, студень (холодец), клей, строительный раствор, известь, кирпич и керамика, пористый шоколад, поролон, крем, мазь, помада, цветные стекла, сплавы.
Содержание отчета: укажите номер лабораторного опыта, тему, цель, оборудование, выполните задания методических указаний, сформулируйте и запишите вывод.
Контрольные вопросы
1.Приведите примеры использования дисперсных систем в быту.
2.Приведите примеры использования дисперсных систем на производстве вашего профиля.
Практическая работа №4
Наименование работы: Приготовление раствора заданной концентрации
Цель работы: освоить расчеты и методику приготовления растворов определенной концентрации.
Продолжительность работы – 2 ч.
Дидактическое оснащение: стакан объемом 50 мл; стеклянная палочка с резиновым наконечником; технические весы с набором разновесов; стеклянная лопаточка или фарфоровая ложечка; мерный цилиндр; холодная кипяченая вода, хлорид натрия, хлорид калия, дистиллированная вода.
Задание
1.Необходимо приготовить 50г 2% раствора соли:
- выполните расчеты;
- взвесьте необходимую массу соли и поместите ее в колбу;
- отмерьте нужное количество воды и добавьте ее в колбу с солью, перемешайте раствор.
2.Выберите 3 задания по своему желанию из предложенного списка, выполните расчеты и приготовьте раствор.
Общий список приготовления растворов:
№ 1.Для полоскания горла используется 2 % раствор соды. Вычислите массу соды и объём воды, которые необходимо взять для приготовления 150 г такого раствора. Приготовьте раствор.
№ 2.Для засолки огурцов применяется 10 % раствор поваренной соли. Вычислите массу соли и объём воды, которые необходимо взять для приготовления 200 г такого раствора. Приготовьте раствор.
№ 3.Перед посадкой семена томатов дезинфицируют (протравливают) 1% раствором перманганат калия. Вычислите массу перманганата калия и объём воды, которые необходимо взять для приготовления 100 г такого раствора.
Приготовьте раствор.
№ 4.Для удаления с побелки ржавых пятен используют 2 % раствор сульфата меди. Вычислите массу сульфата меди и объём воды, которые необходимо взять для приготовления 300 г такого раствора. Приготовьте раствор.
№ 5.Для приготовления компотов из яблок, груш и т.д. используется 40 % раствор сахара. Вычислите массу сахара и объём воды, которые необходимо взять для приготовления 50 г такого раствора. Приготовьте раствор.
№ 6.Для подкормки растений используется 2 % раствор кальциевой селитры. Вычислите массу соды и объём воды, которые необходимо взять для приготовления 150 г такого раствора. Приготовьте раствор.
Краткие теоретические сведения
Растворы играют важную роль в живой и неживой природе, а также в науке и технике. Большинство физиологических процессов в организмах человека, животных и растений, различных промышленных процессов, биохимических процессов в почвах и т.п. протекают в растворах. Раствор – это гомогенная многокомпонентная система, в которой одно вещество распределено в среде другого или других веществ. Растворы могут быть в газообразном, жидком и твердом агрегатных состояниях. Содержание данного вещества в единице массы или объема раствора называется концентрацией раствора. На практике наиболее часто пользуется такой способ выражения концентрации как массовая доля – отношение массы данного компонента в растворе к общей массе этого раствора. Массовая доля может быть выражена в долях единицы, процентах (%), промилле (тысячная часть %) и в миллионных долях (млнˉ1). Массовая доля данного компонента, выраженная в процентах, показывает, сколько граммов данного компонента содержится в 100 г раствора. Для приготовления определённого раствора нужной концентрации обычно составляют пропорцию, где за x принимают массу вещества, которую необходимо растворить, для получения раствора необходимой концентрации. При этом необходимо вычитать массу растворённого вещества из массы раствора, чтобы найти массу растворителя.
Например: приготовить 200 г раствора соли, массовая доля которого 20% или 0,2.
|
![]() Дано:
Дано:
m(р-ра)-200г
![]() c-20%
c-20%
Найти:
m(Н2О)-?
m(соли)-?
Ответ: Для приготовления 20-ти процентного раствора соли, необходимо взять 160 г воды и 40 г соли.
Порядок работы
1. Внимательно прочитайте главу «Краткие теоретические сведения»;
2. Выполните предложенные задания;
3. Оформите отчет.
Содержание отчета: укажите номер лабораторного опыта, тему, цель, оборудование, выполните задания методических указаний, сформулируйте и запишите вывод.
Контрольные вопросы
1.Что такое раствор?
2.Что называется концентрацией раствора?
3.Какие растворы используются в быту и на предприятиях вашего профиля?
Лабораторная работа №5
Наименование работы: Испытание растворов кислот индикаторами. Взаимодействие металлов с кислотами. Взаимодействие кислот с оксидами металлов. Взаимодействие кислот с основаниями. Взаимодействие кислот с солями
Цель работы: исследовать действие кислот на индикаторы, особенности взаимодействия растворов кислот с металлами, оксидами металлов, основаниями, солями на основания их положения в электрохимическом ряду напряжений металлов.
Продолжительность работы – 1 ч.
Дидактическое оснащение: пипетки, пробирки, штатив для пробирок,индикаторы: лакмус, фенолфталеин, метилоранж, универсальная индикаторная бумага; растворы соляной и серной кислоты, штатив для пробирок, спиртовка, спички, пробиркодержатель, гранулы цинка, железные опилки, медные стружки или кусочки медной проволоки, растворы соляной и серной кислоты, фарфоровая ложечка, две стеклянные пластины, тигельные щипцы, порошок оксида железа(III), порошок оксида магния, растворы соляной и серной кислоты, раствор гидроксида натрия, раствор сульфата меди(II), раствор сульфата железа (III), растворы соляной и серной кислоты, растворы: азотной кислоты, силиката калия хлорида бария, серной кислоты, карбоната калия.
Задание
1.Исследовать действие соляной кислоты на индикаторы.
2.Исследовать действие серной кислоты на индикаторы.
3.Проведите реакции, подтверждающие, особенности взаимодействия растворов кислот с металлами на основании их положения в электрохимическом ряду напряжений металлов.
4. Проведите реакции, подтверждающие, особенности взаимодействия растворов кислот с оксидами металлов.
5. Проведите реакции, подтверждающие, особенности взаимодействия растворов кислот с основаниями.
6. Проведите реакции, подтверждающие, особенности взаимодействия растворов кислот и солей.
Краткие теоретические сведения
Кислоты — сложные вещества, в состав которых обычно входят атомы водорода, способные замещаться на атомы металлов, и кислотный остаток. Водные растворы кислот имеют кислый вкус, обладают раздражающим действием, способны менять окраску индикаторов, отличаются рядом общих химических свойств. Различают кислоты бескислородные (HCl, HI, H2S, HCN) и кислородсодержащие (HNO3, H2SO4, H2SO3, H3PO4). Кислоты получают растворением кислотных оксидов в воде: P2O5 + 3H2O = 2H3PO4 или по реакции обмена соли с кислотой: Ca3(PO4)2 + 3H2SO4 = 3CaSO4 + 2H3PO4 Практически все кислоты (кроме кремниевой) хорошо растворимы в воде. Растворы кислот в воде изменяют окраску специальных веществ – индикаторов. Индикаторы представляют собой вещества сложного строения. В растворах оснований и в нейтральных растворах они имеют иную окраску, чем в растворах кислот. По окраске индикаторов определяют присутствие кислоты. Индикаторы лакмус и метиловый оранжевый окрашиваются растворами кислот в красный цвет. Кислоты – электролиты, диссоциирующие в воде на ионы водорода и ионы кислотного остатка. H2SO4 ↔ 2H+ + SO42-Кислоты обладают разнообразными химическими свойствами и взаимодействуют с металлами, основаниями, солями и оксидами металлов.
Для взаимодействия кислот с металлом должны выполняться некоторые условия (в отличие от реакций кислот с основаниями и основными оксидами, которые идут практически всегда). Во-первых, металл должен быть достаточно активным (реакционноспособным) по отношению к кислотам. Например, золото, серебро, медь, ртуть и некоторые другие металлы с выделением водорода с кислотами не реагируют. Такие металлы как натрий, кальций, цинк – напротив – реагируют очень активно с выделением газообразного водорода и большого количества тепла. HCl + Hg = не образуется
H2SO4 + Zn = ZnSO4 + H2
По реакционной способности в отношении кислот все металлы располагаются в ряд активности металлов. Слева находятся наиболее активные металлы, справа – неактивные. Чем левее находится металл в ряду активности, тем интенсивнее он взаимодействует с кислотами.
Во-вторых, кислота должна быть достаточно сильной, чтобы реагировать с металлом. Под силой кислоты понимают ее способность отдавать ионы водорода H+. Например, кислоты растений (яблочная, лимонная, щавелевая и т.д.) являются слабыми кислотами и очень медленно реагируют с такими металлами как цинк, хром, железо, никель, олово, свинец (хотя с основаниями и оксидами металлов они способны реагировать).
Следует помнить, что в реакциях кислот с металлами есть одно важное исключение. При взаимодействии металлов с азотной кислотой водород не выделяется. Концентрированные кислоты с металлами ведут себя иначе, чем разбавленные:
Cu + 4 HNO3(конц.) =Cu(NO3)2 + 2 NO2 + 2 H2O
3 Cu + 8HNO3(разб.) = 3 Cu(NO3)2 + 2 NO + 4 H2O
8 K + 5 H2SO4(конц.) = 4 K2SO4 + H2S + 4 H2O
3 Zn + 4 H2SO4(конц.) = 3 ZnSO4 + S + 4 H2O.
Есть металлы, которые реагируют с разбавленными кислотами, но не реагирует с концентрированными (т.е. безводными) кислотами – серной кислотой и азотной кислотой. Эти металлы – Al, Fe, Cr, Ni и некоторые другие – при контакте с безводными кислотами сразу же покрываются продуктами окисления (пассивируются). Это обстоятельство используют в промышленности. Например, концентрированную серную кислоту хранят и перевозят в железных бочках.
Реакция между кислотой и основанием называется реакцией нейтрализации. Кислота реагируют с основанием с образованием соли, в которой всегда в неизменном виде обнаруживается кислотный остаток. Вторым продуктом реакции нейтрализации обязательно является вода.
Кислота + основание =соль +вода
Например: H2SO4 + Ca(OH)2=CaSO4 +2 H2O
H3PO4+Fe(OH)3 =FePO4+3 H2O
2H3PO4 +3 Ca(OH)2=Ca3(PO4)2 +6 H2O
Для реакций нейтрализации достаточно, чтобы хотя бы одно из реагирующих веществ было растворимо в воде. Поскольку практически все кислоты растворимы в воде, они вступают в реакции нейтрализации не только с растворимыми, но и с нерастворимыми основаниями.
Исключением является кремниевая кислота, которая плохо растворима в воде и поэтому может реагировать только с растворимыми основаниями – такими как NaOH и KOH.
Кислоты вступают в реакции солями. При химических реакциях кислот с солями обязательно надо учитывать основные признаки химических реакций, а именно, химическая реакция пройдёт, если будет выделяться газ, выпадет осадок, и т.д.
В реакции между карбонатами и кислотами выделяется углекислый газ CO2:
Например, Nа2CO3 + 2HCl = 2NaCl + CO2 + H2O.
Конечно, если говорить точно, то образуется слабая угольная кислота (H2CO3), которая сразу же распадается на углекислый газ и воду. Приведенная реакция является качественной на карбонаты. При этих реакциях образуется соль и другая кислота (менее слабая). Таким способом в лаборатории получают многие слабые кислоты.
Результатом взаимодействия кислот с солями так же могут быть осадки: например при реакции серной кислоты с солями бария, соляной кислоты с нитратом серебра и другие. Реакции между кислотами и солями часто используют как качественные.
Порядок работы
1.В три пробирки налейте раствор серной кислоты, добавьте к ним соответственно по 2-3 капли раствора лакмуса, фенолфталеина, метилового оранжевого. Как изменяется окраска индикаторов от действия кислоты? Что наблюдаете?
2.На полоску универсальной индикаторной бумаги нанесите пипеткой по одной капле раствора серной кислоты определите значение рН и его цвет.
3. Заполните таблицу «Действие кислот на индикаторы»
|
Индикатор |
Кислоты |
|
|
HCl |
H2SO4 |
|
|
Лакмус |
|
|
|
Фенолфталеин |
|
|
|
Метилоранж |
|
|
|
Универсальный индикатор (рН от1 до 14) |
|
|
|
Уравнение диссоциациикислоты |
|
|
3.В две пробирки положите гранулы цинка и прилейте в одну пробирку около 1 мл раствора серной кислоты, в другую - столько же соляной кислоты.
4.В другие две пробирки положите немного железных опилок и прилейте те же кислоты.
5.В следующие две пробирки положите немного медных стружек или кусочков проволоки и прилейте те же кислоты.
Если в какой – либо пробирке не происходит реакции, слегка подогрейте содержимое пробирки в пламени спиртовки.
Наблюдайте, в каких пробирках происходит выделение газа. Определите, какой это газ? Все ли металлы вытесняют водород из кислот.
6. Заполните таблицу:
|
№ пробирки |
Что делали? |
Что наблюдали? |
Уравнение реакции В молекулярном и ионном виде |
|
|
|
|
|
7. В две пробирки насыпьте немного оксида железа (III) и прилейте в одну пробирку около 1 мл раствора серной кислоты, в другую - столько же соляной кислоты. Происходят ли изменения? Если реакции не происходят, слегка нагрейте содержимое пробирок. Что наблюдаете? В случае полного растворения оксида железа (III) добавьте ещё порошка оксида и снова нагрейте.
8.Вылейте несколько капель раствора из пробирки, в которую прилили серную кислоту, на стеклянную пластинку и выпарьте его, держа пластинку над пламенем спиртовки. Что осталось на стекле после выпаривания?
9. Заполните таблицу:
|
Что делали? |
Что наблюдали? |
Уравнение реакции В молекулярном и ионном виде |
10.В пробирку налейте 2 мл раствора гидроксида натрия и прибавьте 1-2 капли фенолфталеина. Что наблюдаете?
11.К раствору щёлочи с фенолфталеином приливайте по каплям соляную кислоту, периодически взбалтывая содержимое пробирки. Что вы наблюдаете? Образование, какого вещества привело к изменению окраски индикатора? Потрогайте рукой пробирку, в которой проводили опыт.
Сделайте вывод о тепловом эффекте проделанной реакции.
12.Поместите 1-2 капли раствора из пробирки на стеклянную пластину и выпарьте. Что образуется? Заполните таблицу;
|
Что делали? |
Что наблюдали? |
Уравнение реакции В молекулярном и ионном виде |
13. Слейте попарно растворы следующих веществ:
1-я пробирка: азотная кислота и силикат калия;
2-я пробирка: серная кислота и карбонат калия;
3-я пробирка: серная кислота и хлорид бария
14. Заполните таблицу:
|
№ пробирки |
Что делали? |
Что наблюдали? |
Уравнение реакции В молекулярном и ионном виде |
Содержание отчета: укажите номер лабораторного опыта, тему, цель, оборудование, выполните задания методических указаний, сформулируйте и запишите вывод.
Контрольные вопросы
1.С какими из перечисленных веществ взаимодействует соляная кислота: Mg, Cu, Ca, Cu, Fe?
2.При помощи, каких реакций можно осуществить следующие превращения:
Zn → ZnS → ZnO → ZnCl2 → Zn(OН)2
3.Подобрать коэффициенты в уравнении реакции, указать окислитель, восстановитель, процесс окисления и восстановления:
Cu + Cl2®CuCl2
Zn + HCl®ZnCl2 + H2
Лабораторная работа №6
Наименование работы: Испытание растворов щелочей индикаторами. Взаимодействие щелочей с солями. Разложение нерастворимых оснований
Цель работы: исследовать действие индикаторов на растворы щелочей, взаимодействие щелочей с солями и основаниями.
Продолжительность работы – 1 ч.
Дидактическое оснащение: пробирки, штатив для пробирок, индикаторы: лакмус, фенолфталеин, метилоранж, универсальная индикаторная бумага; раствор гидроксида калия или натрия, известковая вода (гидроксид кальция),спиртовка, спички, пробиркодержатель, растворы: гидроксида калия или натрия, раствор сульфата меди (II), раствор хлорида аммония, растворы: гидроксида калия или натрия, раствор сульфата меди (II).
Задание
1. Исследовать действие раствора гидроксида калия или натрия на индикаторы.
2. Исследовать действие раствора известковой воды на индикаторы.
3.Проведите реакции, подтверждающие, особенности взаимодействия растворов щелочей и солей. При каких условиях щёлочи взаимодействуют с солями?
4. Получите нерастворимое основание меди и изучите его свойства.
Краткие теоретические сведения
Основания - сложные вещества, в которых атомы металлов соединены с одной или несколькими гидроксильными группами (с точки зрения теории электролитической диссоциации, основания - сложные вещества, при диссоциации которых в водном растворе образуются катионы металла (или NH4+) и гидроксид – анионы (OH-).
Классификация.
Растворимые в воде (щёлочи) и нерастворимые. Амфотерные основания проявляют также свойства слабых кислот
1.Индикаторы в щелочных растворах меняют окраску:
-лакмус приобретает синий цвет;
-бесцветный фенолфталеин становится малиновым;
-метиловый оранжевый – желтым
2.Взаимодействие с кислотными оксидами.
2KOH + CO₂=K₂CO₃ + H₂O
3.Взаимодействие с кислотами (реакция нейтрализации)
NaOH +HNO₃ =NaNO₃ +H₂O
Cu(OH)₂ + 2HCl =CuCl₂ + 2H₂O
4.Обменная реакция с солями:
Ba(OH)₂ + K₂SO₄ =2KOH + BaSO4
3KOH+Fe(NO₃)₃ =Fe(OH)₃+ 3KNO₃
5.Термический распад.
Cu(OH)₂–t°=CuO + H₂O
Типичные реакции оснований.
1.основание + кислота основание = соль+вода (Реакции обмена и нейтрализации).
NaOH + НCl = NaCl +H2O
2.щелочь +оксид неметалла= соль+вода (Реакции обмена).
2NaOH+ N2O3=2NaNO2+H2O
3.щелочь+соль=новое основание+новая соль (Реакция обмена)
2NaOH+ CuSO4= Na2SO4+Cu(OH)2↓
Порядок работы
1.В три пробирки налейте раствор гидроксида калия или натрия, добавьте к нему соответственно по 2-3 капли раствора лакмуса, фенолфталеина, метилового- оранжевого. Как изменяется окраска индикаторов от действия щелочи? Что наблюдаете?
2.На полоску универсальной индикаторной бумаги нанесите пипеткой по одной капле раствора гидроксида калия или натрия, определите значение рН и его цвет.
В пробирку налейте 1мл раствора гидроксида калия или гидроксида натрия и прибавьте 1мл нитрата аммония. Смесь слегка нагрейте. Что наблюдаете? Какой газ выделяется?
3.В три пробирки налейте раствор известковой воды, добавьте к нему соответственно по 2-3 капли раствора лакмуса, фенолфталеина, метилового - оранжевого. Как изменяется окраска индикаторов от действия щелочи? Что наблюдаете?
4.На полоску универсальной индикаторной бумаги нанесите пипеткой по одной капле раствора известковой воды, определите значение рН и его цвет. Заполните таблицу:
|
Индикатор |
Основания |
|
|
КOH |
Ca(OH)2 |
|
|
Лакмус |
|
|
|
Фенолфталеин |
|
|
|
Метилоранж |
|
|
|
Универсальный индикатор (рН от1 до 14) |
|
|
|
Уравнение диссоциации щелочи |
|
|
5..В пробирку налейте 1мл раствора гидроксида калия или гидроксида натрия и осторожно по каплям добавляйте в данную пробирку раствор сульфата меди (II). Что наблюдаете?
6. Заполните таблицу:
|
Что делали? |
Что наблюдали? |
Уравнение реакции В молекулярном и ионном виде |
7. Получите нерастворимое основание меди, налив в пробирку 1 мл сульфата меди (II) и добавив несколько капель гидроксида натрия. Опишите физические свойства гидроксида меди (II)
8. Нагрейте гидроксид меди (II) на спиртовке. Что наблюдаете? Какие вещества образовались в результате реакции? Заполните таблицу:
|
Что делали? |
Что наблюдали? |
Уравнение реакции |
Содержание отчета: укажите номер лабораторного опыта, тему, цель, оборудование, выполните задания методических указаний, сформулируйте и запишите вывод.
Контрольные вопросы
1.Дайте определение основания исходя из их состава
2.На какие группы делят основания?
3.Даны соли: KNO3, Na2SO4,MgCl2, FeCl3, NH4Cl.С какими из данных солей будет реагировать гидроксид бария? Составьте уравнения реакций в молекулярном и в ионном виде.
Лабораторная работа №7
Наименование работы: Взаимодействие солей с металлами. Взаимодействие солей друг с другом. Гидролиз солей различного типа
Цель работы: исследовать химические свойства солей: взаимодействие с металлами, с солями, гидролиз солей.
Продолжительность работы – 1ч.
Дидактическое оснащение: железная проволока (скрепка), свинцовая пластина, медная проволока, пробирки, штатив для пробирок, растворы сульфата меди (II), сульфата железа (II), растворы хлорида натрия, фосфата натрия и иодида натрия, растворы карбоната натрия Na2CO3, сульфида натрия Na2S, хлорида аммония NH4Cl, сульфата цинка ZnSO4, сульфата калия K2SO4, универсальный индикатор, шкала индикатора.
Задание
1.Проведите реакции, подтверждающие, особенности взаимодействия растворов солей с металлами на основании их положения в электрохимическом ряду напряжений металлов.
2. Исследуйте взаимодействие солей друг с другом.
3. Определите реакцию растворов солей Na2CO3, Na2S, NH4 Cl,, ZnSO4, K2SO4.
Краткие теоретические сведения
Соли – сложные вещества, состоящие из атомов металла и кислотных остатков. Исключением являются соли аммония, в которых с кислотными остатками связаны не атомы металла, а частицы NH4+
Примеры типичных солей приведены ниже.
NaCl – хлорид натрия, Na2SO4 – сульфат натрия, СаSO4 – сульфат кальция, СаCl2 – хлорид кальция, (NH4)2SO4 – сульфат аммония. Формула соли строится с учетом валентностей металла и кислотного остатка.
Практически все соли – ионные соединения, поэтому можно говорить, что в солях связаны между собой ионы металла и ионы кислотных остатков:
NaCl – хлорид натрия Ca2SO4 – сульфат кальция и т.д.
Названия солей составляются из названия кислотного остатка и названия металла. Главным в названии является кислотный остаток.
Свойства солей будут связаны с наличием в составе вещества того или иного металла или кислотного остатка. Например, большинство солей меди в растворе имеют голубоватую окраску. Соли марганцовой кислоты (перманганаты) в основном фиолетовые.
Химические свойства солей определяются свойствами катионов и анионов, входящих в их состав.
Соли взаимодействуют с кислотами и основаниями, если в результате реакции получается продукт, который выходит из сферы реакции (осадок, газ, мало диссоциирующие вещества, например, вода)
BaCl2(тверд.) +H2SO4(конц.)=BaSO4↓ +2HCl↑
NaHCO3 + HCl(разб.)=NaCl+CO2↑ +H2O
Na2SiO3 +2HCl(разб.)=SiO2↓ + 2NaCl + H2O
Соли взаимодействуют с металлами, если свободный металл находится левее металла в составе соли в электрохимическом ряде активности металлов:
Cu+HgCl2=CuCl2+Hg
Соли взаимодействуют между собой, если продукт реакции выходит из сферы реакции; в том числе эти реакции могут проходить с изменением степеней окисления атомов реагентов:
CaCl2 +Na2CO3=CaCO3↓ + 2NaCl
NaCl(разб.)+AgNO3=NaNO3 +AgCl↓
3Na2SO3 + 4H2SO4(разб.)+K2Cr2O7=3Na2SO4+Cr2(SO4)3 + 4H2O + K2SO4
Некоторыесолиразлагаютсяпринагревании:
CuCO3=CuO+CO2↑
NH4NO3 = N2O↑ + 2H2O
NH4NO2 = N2↑ + 2H2OСоли – электролиты диссоциирующие на ионы металла и кислотного остатка.
Ca (NO3)2 ↔ Ca2+ + 2NO-3
Соли взаимодействуют:
- с солями, если образуется нерастворимая соль
3Na2S + 2FeCl3 = 6NaCl + Fe2S3↓
- с металлами, более активный металл вытесняет из раствора соли менее активный
CuCl2 + Zn = ZnCl2 + Cu
- со щелочами
2NaOH + ZnCl2 = 2NaCl +Zn(OH)2↓
- с более сильными кислотами, чем кислота, образующая соль
FeS + 2HCl = H2S + FeCl2
Многие соли подвергаются процессу под названием гидролиз — реакция обмена растворимых солей-электролитов с водой. Движущей силой процесса является взаимодействие ионов, образующихся при диссоциации этих солей с водой, приводящее к образованию слабого электролита в ионном или (реже) молекулярном виде («связывание ионов»). Различают обратимый и необратимый гидролиз солей:
1. Гидролиз соли слабой кислоты и сильного основания (гидролиз по аниону): (раствор имеет слабощелочную среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
2. Гидролиз соли сильной кислоты и слабого основания (гидролиз по катиону): (раствор имеет слабокислую среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени) Гидролиз протекает необратимо, если в результате реакции образуется нерастворимое основание и (или) летучая кислота:
3. Гидролиз соли слабой кислоты и слабого основания (необратимый): (равновесие смещено в сторону продуктов, гидролиз протекает практически полностью, так как оба продукта реакции уходят из зоны реакции в виде осадка или газа).
4. Соль сильной кислоты и сильного основания гидролизу не подвергается.
Порядок работы
1. Поместите в 1-ю пробирку железную проволоку (скрепку), во 2-ю - свинцовую пластину, а в 3-ю - медную проволоку
2.Налейте в 1-ю и 2-ю пробирки по 2 мл сульфата меди (II), а в 3-ю-раствор сульфата железа (II).
3.Через 5 мин извлеките металлические тела из раствора и рассмотрите их. Заполните таблицу:
|
Что делали |
Формула соли |
Цвет раствора соли |
Изменения на поверхности металла |
Изменения цвета раствора |
4. В каждую из трех пробирок с раствором хлорида, фосфата и иодида натрия соответственно прилейте несколько капель раствора нитрата серебра (I). Что наблюдаете?
|
№ пробирки |
Что делали? |
Что наблюдали? |
Уравнение реакции В молекулярном и ионном виде |
5. Впять пробирок прилить растворы карбоната натрия, сульфида натрия, хлорида аммония, сульфата цинка, сульфата калия.
7.Установить характер среды растворов при помощи универсального индикатора. Записать значения рН данных растворов согласно прилагающийся цветовой шкалы.
|
Соль |
Какимо снованием образуется |
Какой кислотой образуется |
Среда раствора, рН |
Реакция гидролиза вывод |
|
Na2 CO3 Na2 S NH4 Cl Zn SO4 K2 SO4 |
|
|
|
|
Содержание отчета: укажите номер лабораторного опыта, тему, цель, оборудование, выполните задания методических указаний, сформулируйте и запишите вывод.
Контрольные вопросы
1.Что такое гидролиз?
2.От чего зависит реакция среды солей?
3.Назовите сильные катионы и анионы
4.Какой ион участвует в реакции гидролиза? Какой ион определяет среду раствора?
5.Как влияет на степень гидролиза сила кислот и оснований?
Лабораторная работа №8
Наименование работы: Реакция замещения меди железом в растворе медного купороса. Реакции, идущие с образованием осадка, газа или воды
Цель работы: изучить протекание реакций замещения на примере взаимодействия железа с сульфатом меди, осуществить практически реакции ионного обмена, выяснить условия протекания химических реакций между растворами электролитов до конца.
Продолжительность работы – 1 ч.
Дидактическое оснащение: пробирки, штатив для пробирок, железный гвоздь, пробирка с раствором сульфата меди(медного купороса CuSO4), растворы следующих солей: сульфат натрия, хлорид бария, карбонат натрия, соляная кислота, гидроксид калия, фенолфталеин.
Задание
1.Осуществите реакцию замещения меди железом в растворе медного купороса.
2. Проведите реакции ионного обмена, идущие с образованием осадка, газа или воды.
Краткие теоретические сведения
Реакции замещения - реакции между простыми и сложными веществами, при котором атомы простого вещества замещают атомы одного из элементов в сложном веществе. К такому типу реакций относится взаимодействие между металлами и кислотами, металлами и солями. При этих реакциях необходимо учитывать положение металла в ряду напряжений (ряд Бекетова), а также силу кислот и растворимость солей. Железо легко вытесняет медь в химической реакции замещения. Если в раствор медного купороса опустить металлическое изделием будем наблюдать на поверхности железа образование микроскопических кристаллов химически чистой меди красно-бурого цвета. При этом голубой раствор медного купороса постепенно бледнеет и приобретает зеленоватый окрас, происходит образование железного купороса FeSO4x5H2O. Но это способ не эффективен для прочного медного покрытия, поэтому для более качественного нанесения медного покрытия используют электричество. Таким способом (реакцией замещения) можно покрыть металлом, стоящим правее металл стоящий левее в ряду напряжений.
Необратимые реакции протекают до конца, если выполняется три условия: выпадает осадок, образуется газообразное вещество и образуется малодиссоциирующее вещество (вода).
Образование осадка.
NaCl + AgNO3= AgCl↓ + NaNO3 молекулярное уравнение
Na+ +Cl-+Ag++NO3-=AgCl↓ +Na+ +NO3—полное ионное уравнение
Ag+ +Cl-=AgCl↓-сокращенное ионное уравнение
Образование газообразного вещества.
(NH4)2S+2HCl=2NH4Cl+H2S↑
2NH4+ +S2- +2H++2Cl-=2NH4+ +2Cl-+H2S↑
2H+ +S2-=H2S↑
Образование воды.
H2SO4+2KOH=K2SO4+2H2O
2H+ +SO42- +2K+ +2OH-=2K+ +SO42-+2H2O
2H+ +2OH-=2H2O
Порядок работы
1.Опустите железный гвоздь в пробирку с медным купоросом, наблюдайте за происходящими изменениями цвета поверхности гвоздя и раствора соли в течение 10 минут. Что наблюдаете?
2. Заполните таблицу:
|
Что делали? |
Что наблюдали? |
Уравнение реакции В молекулярном и ионном виде |
Вывод |
3. В пробирку прилейте 1-2 мл раствора сульфата натрия, а затем добавьте 1-2 мл раствора хлорид бария.
Что наблюдаете? Напишите уравнение реакции в молекулярной и ионной форме.
4.В пробирку прилейте 1-2 мл раствора карбоната натрия, а затем добавьте 1-2 мл раствора соляной кислоты. Что наблюдаете? Напишите уравнение реакции в молекулярной и ионной форме.
5.В пробирку с гидроксидом калия добавьте фенолфталеин до появления малиновой окраски индикатора, затем понемногу добавляйте кислоту до исчезновения окраски. Что наблюдаете? Заполните таблицу:
|
Что делали? |
Что наблюдали? |
Уравнение реакции В молекулярном и ионном виде |
Вывод |
Содержание отчета: укажите номер лабораторного опыта, тему, цель, оборудование, выполните задания методических указаний, сформулируйте и запишите вывод.
Контрольные вопросы
1.Какие реакции относятся к реакциям замещения?
2.В каком случае возможна реакция замещения: между серебром и хлоридом железа или между железом и нитратом серебра? Ответ обоснуйте.
3.В виде, каких частиц преимущественно присутствуют в растворе сильные электролиты, слабые электролиты?
4.Как записываются сильные электролиты в ионных уравнениях реакций?
5.Как записываются слабые электролиты, осадки и газообразные вещества в ионных уравнениях реакций?
Лабораторная работа №9
Наименование работы: Зависимость скорости взаимодействия соляной кислоты с металлами от их природы. Зависимость скорости взаимодействия цинка с соляной кислотой от ее концентрации. Зависимость скорости взаимодействия оксида меди (II) с серной кислотой от температуры
Цель работы: рассмотреть и объяснить влияние различных факторов на скорость химических реакций.
Продолжительность работы – 1 ч.
Дидактическое оснащение: штатив, пробирки, стакан, термометр, секундомер, цинк гранулированный, пластинка магния, медная проволока, раствор соляной кислоты, цинк гранулированный, термометр, секундомер, оксид меди (II), серная кислота.
Задание:
1. Используя знания о влияние различных факторов на скорость химических реакций, проведите опыты: 1.зависимость скорости реакции от природы реагирующих веществ, 2. зависимость скорости реакции от концентрации реагирующих веществ, 3 зависимость скорости реакции от температуры.
Краткие теоретические сведения
Под скоростью химических реакций понимают изменение концентрации одного из реагирующих веществ в единицу времени при неизменном объёме системы.
Рассмотрим в общем виде скорость реакции, протекающей по уравнению:
nА + mВ = pС + qD
Скорость химической реакции зависит от природы и состояния реагирующих веществ и условий, при которых протекает реакция (температуры, концентрации реагирующих веществ, наличия катализатора).
1.Влияние природы реагирующих веществ.Соединения с ионной или ковалентной полярной связью в водных растворах взаимодействуют между собой очень быстро. Скорость взаимодействия соединений с неполярной ковалентной связью зависит от их химических свойств. Например, реакция водорода с фтором протекает очень быстро (с взрывом) при комнатной температуре, а реакция водорода с йодом происходит медленно во время нагревания.Скорость химической реакции зависит от природы реагирующих веществ. Чем активнее металл, тем он более реакционно способен.
2 Влияние концентрации реагирующих веществ – на основе обширного экспериментального материала сформулирован основной закон химической кинетики.
Скорость химической реакции пропорциональна произведению концентрации реагирующих веществ.
Для формулы (3.6) этот закон выразится уравнением:
Υ = kCA nCB m
Где CA и CB – концентрации веществ А и В, моль/л; k – коэффициент пропорциональности, называемый константой скорости реакции. Основной закон химической кинетики часто называют законом действующих масс. Чем выше концентрация реагирующих веществ, тем чаще столкновения их частиц и тем выше скорость химической реакции.
3 Влияние температуры. Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа:
При повышении температуры на каждые 100С скорость большинства реакций увеличивается в 2 -4 раза.
Математически эта зависимость выражается по формуле:
![]()
где ![]()
![]() ,
, ![]()
![]() - скорости
реакции соответственно при начальной (t1) и конечной (t2)
температурах, а γ – температурный коэффициент скорости реакции, который
показывает, во сколько раз увеличивается скорость реакции с повышением
температуры реагирующих веществ на 100 С. При повышении
температуры возрастает скорость движения частиц и скорость химической реакции.
- скорости
реакции соответственно при начальной (t1) и конечной (t2)
температурах, а γ – температурный коэффициент скорости реакции, который
показывает, во сколько раз увеличивается скорость реакции с повышением
температуры реагирующих веществ на 100 С. При повышении
температуры возрастает скорость движения частиц и скорость химической реакции.
Порядок работы
1. Взять три пробирки, в первую поместить магниевую пластинку, во вторую гранулированный цинк, а в третью медную проволоку. Добавьте в каждую пробирку 2-3 мл соляной кислоты одинаковой концентрации. Что наблюдаете? Заполните таблицу:
|
Что делали? |
Что наблюдали? |
Уравнение реакции
|
Вывод |
2.В три пробирки налить соответственно 0,5мл; 1мл; 1,5мл раствора соляной кислоты. В первую добавьте 1мл воды, во вторую – 0,5мл (концентрация раствора соляной кислоты в пробирках стала 1С;2С;3С). Затем в каждую из пробирок опустите по одной грануле цинка Что наблюдаете? Заполните таблицу:
|
Что делали? |
Что наблюдали? |
Уравнение реакции
|
Вывод |
3. В пробирку поместите немного черного порошка оксида меди (II) и прилейте раствор серной кислоты. Отметив температуру воздуха в классе, встряхивают и определяют время (t1) до начала помутнения смеси по секундомеру. Записать наблюдаемые явления.
4.В пробирку поместите немного черного порошка оксида меди (II) и прилейте раствор серной кислоты. Поместить пробирку в стакан с горячей водой (на 100 выше комнатной) и определить время (t2) до начала помутнения смеси по секундомеру. Записать и объяснить наблюдаемые явления. Определить, как изменится скорость реакции при повышении температуры на 100С.
5.Повторяют опыт с пробиркой, нагретой на 200 выше комнатной температуры. Записать и объяснить наблюдаемые явления. Рассчитать, как изменится скорость реакции при повышении температуры на 200С. Заполнить таблицу:
|
Что делали? |
Что наблюдали? |
Уравнение реакции
|
Вывод |
Содержание отчета: укажите номер лабораторного опыта, тему, цель, оборудование, выполните задания методических указаний, сформулируйте и запишите вывод.
Контрольные вопросы
1.Перечислить факторы, влияющие на скорость реакции
2.Как скорость химической реакции зависит от природы реагирующих веществ.
3.Почему скоропортящиеся продукты хранят в холодильнике?
4.Как зависит скорость химической реакции от концентрации реагирующих веществ?
Лабораторная работа №10
Наименование работы: Закалка и отпуск стали. Ознакомление со структурами серого и белого чугуна. Распознавание руд железа
Цель работы: ознакомление с образцами исходных материалов и продуктов чёрной металлургии, дать понятие о сплавах, их классификации и свойствах.
Продолжительность работы – 1 ч.
Дидактическое оснащение: тигельные щипцы, горелка, химический стакан, вода, швейная игла, лезвие безопасной бритвы, фарфоровая ступка, белая кафельная плитка, коллекции «Железные руды».
Задание
1.Исследовать сплавы железа.
2.Ознакомиться с образцами природных соединений железа.
Краткие теоретические сведения
Сплавы черной металлургии
Чугун – сплав на основе железа, содержащий от 2 до 4,5% углерода, а также марганец, кремний, фосфор и серу. Чугун значительно тверже железа, обычно он очень хрупкий, не куется, а при ударе разбивается. Этот сплав применяется для изготовления различных массивных деталей методом литья, так называемый литейный чугун и для переработки в сталь – передельный чугун.
В зависимости от состояния углерода в сплаве различают серый и белый чугун.
Сталь – сплав на основе железа, содержащий менее 2% углерода. По химическому составу стали делят на два основных вида: углеродистая и легированная стали.
Углеродистая сталь представляет собой сплав железа главным образом с углеродом, но, в отличие от чугуна, содержание в ней углерода, а также других веществ гораздо меньше. В зависимости от количества углерода стали подразделяют на мягкие(0,3%С), средней твердости и твердые (до2%С). Из мягкой и средней твердости стали делают детали машин, трубы, гвозди, скрепки и т. д., а из твердой – различные инструменты.
Легированная сталь – это тоже сплав железа с углеродом, только в него введены еще специальные, легирующие добавки: хром, никель, вольфрам, молибден и др.
Легирующие добавки придают сплаву особые качества. Так, хромоникелевые стали очень пластичные, прочные, жаростойкие, кислотоупорные, устойчивые против коррозии. Они применяются в строительстве, а также для изготовления нержавеющих предметов домашнего обихода (ножей, вилок, ложек), всевозможных медицинских и других инструментов. Хромомолибденовые и хромованадиевые стали очень твердые, прочные и жаростойкие. Они используются для изготовления трубопроводов, компрессоров, моторов и многих других деталей машин современной техники.
Стали – это основа современного машиностроения, оборонной промышленности, ракетостроения и других отраслей промышленности.
Сплавы цветной металлургии
Бронза — сплав меди с другими элементами, в основном с металлами. В зависимости от состава различают: оловянную бронзу (состоит из меди и олова), алюминиевую бронзу (содержит до 5—11% алюминия), свинцовую (до 33% свинца), кремниевую (до 4% кремния) и др. Применяют для изготовления мастей машин и для художественных отливок. Бронза хорошо отливается, поэтому используется в машиностроении, где из нее изготавливают подшипники, поршневые кольца, клапаны, арматуру и т. д. Используется также для художественного литья.
Латунь — сплав меди с цинком (до 30—35% цинка). Обладает высокой пластичностью. Используют для изготовления приборов, деталей машин, предметов домашнего обихода и другие сплавы цветной металлургии.
Чугун и сталь – важнейшие сплавы железа. Им можно придавать необходимые качества, меняя состав и условия обработки.
Например, если изделие из стали раскалить на пламени горелки и постепенно охладить, то изделие теряет свою упругость, его можно легко согнуть. В данном случае происходит отпуск стали. Если изделие из стали снова накалить до красна и немедленно охладить в холодной воде, то оно перестанет гнуться, а при попытке согнуть его — ломается. В данном случае происходит закалка стали.
Важнейшими железными рудами являются:
Fe3O4 – магнетит(магнитный железняк) 72% Fe
Fe2O3 – гематит (красный железняк) 65% Fe
Fe2O3 х nH2O – лимонит (бурый железняк) 60% Fe
Fe2S – пирит (серный колчедан) 46,6% Fe
Fe2СO3 – сидерит (железный шпат) 35% Fe
В современной технике и в обыденной жизни применяются сплавы железа: чугун, сталь. Эти сплавы отличаются разным содержанием углерода. В чугуне углерода содержится от 1,7% до 5%, в стали – от 0,3% до 1.7%.
Для получения чугуна и стали перерабатываются железные руды, содержащие железо в виде оксидов, поэтому в основе химического получения чугуна лежит процесс восстановления железа из оксидов углеродом и оксидом углерода(II).
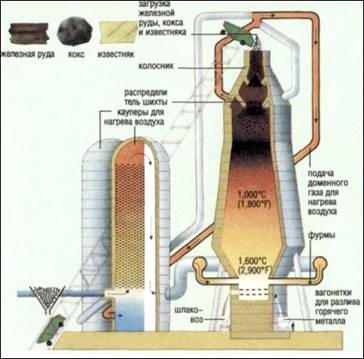
Процесс выплавки чугуна ведут в доменных печах. Доменная печь – сложное сооружение, высота которого 25 – 30 м, диаметр 6 – 8 м. Конструктивно домна имеет форму двух усечённых конусов, соединённых основаниями. Домна выложена из огнеупорного кирпича, снаружи покрыта стальным кожухом (для прочности). В домну сверху загружают шихту, которая состоит из чередующихся слоёв руды, кокса, флюсов (плавни). Обогащённая руда содержит обычно 65 – 72% оксидов железа.
Кокс служит источником теплоты, является восстановителем, из него образуется оксид углерода (II), играющий роль восстановителя металла из руды. Кокс также нужен для науглероживания железа.
Флюсы (чаще всего известняк СаСО3) необходимы для вывода пустой породы в виде шлаков, состоящих главным образом из силикатов и алюмосиликатов кальция. Они предохраняют восстановленное железо от окисления и служат для понижения температуры плавления руды.
Снизу в домну подаётся смесь воздуха с кислородом или чистый кислород, предварительно нагрев до 600 – 8000С. Раскалённый уголь (кокс) реагирует с кислородом:
С +О2=СО2
Оксид углерода (IV) реагирует с раскалённым углём с образованием СО:
СО2+С =2СО
СО восстанавливает железо из его оксидов по схеме:
Fe2O3→Fe3O4→FeO→Fe
Свободное железо постепенно опускается вниз в зону более высоких температур, плавится и науглероживается, образуя карбид железа или цементит:
3Fe+С=Fe3С
3Fe+2СО =Fe3С +СО2
Так происходит образование чугуна. Находящиеся в руде примеси серы, фосфора, кремния, марганца восстанавливаются раскалённым коксом.
Восстановленные S,P,Si,Mn частично растворяются в расплавленном чугуне, частично уходят в шлак. Доменный процесс – непрерывный. Чугун и шлак периодически выпускают из печи через специальные желоба. Остановка доменной печи производится лишь раз в несколько лет для капитального ремонта. В доменных печах получают три вида чугунов: литейный, передельный, специальный.
Литейный чугун содержит углерод в виде графита, используется для отливки чугунных изделий. Этот чугун называют ещё серым, так как на изломе он имеет серый цвет.
Передельный чугун содержит углерод в виде цементаFe3С, используется для переработки в сталь. Имеет ещё название белый чугун.
Специальные чугуны различаются содержанием С,P,Si,Mn. Используются для производства высококачественной стали, для изготовления конструкционных материалов в машиностроительной и приборостроительной промышленности.
Сырьём для получения стали служит передельный чугун, флюсы, металлолом. Процесс переработки чугуна в сталь сводится к удалению из него избытка
С,P,Si,Mn и других элементов. При высокой температуре кислород легко соединяется с углеродом и другими примесями, образуя оксиды. Оксид углерода (II) удаляется в виде газа, а остальные реагируют с флюсами, образуется шлак, всплывающий на поверхность стали.
По способам окисления примесей различают два конверторных процесса: бессемеровский и томасовский, а также мартеновский и электротермический. Переделку чугуна в сталь ведут при температуре 18000С. Процесс плавки длится 5 -6 ч.
Порядок работы
1.Рассмотрите выданные вам образцы сплавов железа.
2.Исследуйте цвет поверхности сплавов железа, их твёрдость, свойство притягиваться магнитом, коррозионную стойкость.
3.Швейную иглу или лезвие безопасной бритвы возьмите тигельными щипцами, раскалите на пламени горелки и постепенно охладите. Проверьте на упругость. Что произошло?
4.Иголку или половинку лезвия снова накалите до красна и немедленно охладите в холодной воде. Проверьте на упругость. Что произошло?
5. Заполните таблицу 1 и 2:
Таблица 1. Сплавы железа
|
Название сплава |
Состав |
Свойства |
Применение |
|
|
|
|
|
|
|
|
|
|
Таблица 2. Проведенные опыты
|
Опыт |
Что наблюдали |
Вывод
|
|
1. |
|
|
|
2. |
|
|
6.Рассмотрите выданные образцы природных соединений железа (магнетит, гематит, лимонит).
7.Проведите поочередно магнетитом, гематитом, лимонитом по стенке фарфоровой ступки или обратной стороне белой кафельной плитке. По цвету остающейся полосы идентифицируйте каждую руду.
8. Заполните таблицу 3:
Таблица 3 «Важнейшие железные руды»
|
Название минерала
|
Формула и название основной составной части
|
Внешний вид
|
Цвет полосы минерала |
Применение
|
|
|
|
|
|
|
Содержание отчета: укажите номер лабораторного опыта, тему, цель, оборудование, выполните задания методических указаний, сформулируйте и запишите вывод.
Контрольные вопросы
1.Чем отличается чугун от стали.
2.Дайте определения следующим понятиям: закалка стали, отпуск стали.
3.Почему на практике человек чаще использует не чистые вещества, а сплавы?
4.Как введение легирующих элементов отражается на свойствах стали?
5.Какой процесс лежит в основе химического получения чугуна при переработке железных руд.
Практическое занятие № 11
Наименование работы: Получение, собирание и распознавание газов
Цель работы: изучить процессы и химизм получения газов на примере водорода, кислорода и углекислого газа.
Продолжительность работы – 1ч.
Дидактическое оснащение: пробирки, спиртовка, лучинка, цинк в гранулах, раствор соляной кислоты, мел, раствор пероксида водорода, оксид марганца (II).
Задание
1. Получите, соберите и распознайте следующие газы: водород, кислород, углекислый газ.
Краткие теоретические сведения
Строение газообразных веществ отличается от строения вещества в твердом и жидком состояниях. Газы не имеют собственной формы и расширяются до тех пор, пока не заполнят весь сосуд, принимая его форму, по этой же причине газы не имеют собственного объема. Объем газа определяется объемам сосуда. Газ оказывает на стенки сосуда одинаковое давление во всех направлениях. Газы легко сжимаются. Благодаря большому расстоянию между молекулами газы смешиваются друг с другом в любом отношении. Основные газы, получаемые и используемые в лабораториях это водород, кислород, углекислый газ. Лабораторные способы получения этих газов:
Водород получают в аппарате Кипа, при взаимодействии соляной кислоты и металлического цинка (в гранулах) - при комнатной температуре:
Zn + 2HCl = ZnCl2 + H2
Оксид углерода (IV) (углекислый газ) можно получить, действуя соляной или разбавленной серной кислотой на мрамор (основное вещество - карбонат кальция) или другой карбонат (при комнатной температуре). Сильная кислота (серная или соляная) будет вытеснять слабую угольную кислоту из её солей; угольная кислота нестойкая, поэтому практически сразу разлагается на углекислый газ и воду:
СаСО3 + 2HCl = CaCl2 + CO2 + H2O
Можно получить углекислый газ, сжигая лучину, бумагу или кусочек угля.
Кислород можно получить разложением при нагревании бертолетовой соли или лучше перманганата калия:
2KClO3 = 2KCl + 3O2 (есть опасность взрыва)
2KMnO4 = K2MnO4 + MnO2 + O2
Собирание газов.
В устройстве аппарата Кипа предусмотрена газоотводная трубка с краником; для получения углекислого газа и кислорода реактивы помещают в пробирку и закрывают её пробкой с газоотводной трубкой. Пробирку с перманганатом калия закрепляют в штативе и нагревают пламенем спиртовки. Водород легче воздуха, поэтому его собирают над воздухом, в перевёрнутую пробирку. Кислород и углекислый газ тяжелее воздуха, поэтому их можно собирать вытеснением воздуха, опустив газоотводную трубку на дно пробирки. Кислород, кроме того, мало растворим в воде, поэтому его можно также собирать над водой, в перевёрнутую пробирку (этот способ лучше, т.к. разница молярных масс кислорода (32 г/моль) и воздуха (29 г/моль) невелика). Чтобы распознать эти газы, нужно знать их свойства. Так, кислород поддерживает горение - опущенная в пробирку с кислородом тлеющая лучинка начинает ярко гореть; углекислый газ не поддерживает горение - горящая лучинка, опущенная в пробирку с углекислым газом, гаснет. Углекислый газ, кроме того, мутит известковую воду: при его взаимодействии с гидроксидом кальция ("известковой водой") образуется нерастворимый в воде осадок карбоната кальция:
Са(ОН)2 + СО2 = СаСО3 + Н2О
Чистый водород сгорает легким звуком «пах», водород с примесью воздуха взрывоопасен «гремучий газ» и в небольшом количестве сгорает с резким лающим звуком.
Прибор для получения газов состоит из пробирки, воронки с длинным отростком, вставленной в резиновую пробку, трех неподвижных чашек-насадок с буртиками и отверстиями в дне чашек, газоотводной резиновой трубки, наконечника, пружинного зажима и стеклянной выводной трубки.
В приборе можно получить небольшие количества газов: водорода, углекислого
газа, кислорода, хлора (рис 1).
Рис. 1 Прибор для получения и собирания газов.

Порядок работы
1.В пробирку поместить две гранулы цинка.
2.Прилить 2 мл раствора соляной кислоты. Что наблюдаете? Запишите уравнение реакции с точки зрения окислительно-восстановительного процесса. 3.Накрыть пробирку-реактор пробиркой большего диаметра.
4.Через 4 минуты поднимите большую пробирку и, не переворачивая, поднесите её к пламени спиртовки. Что наблюдаете? Запишите уравнение реакции. Что можете сказать о «чистоте» собранного водорода?
В пробирку прилить 5 мл раствора пероксида водорода.
5.Подготовьте тлеющую лучину.
6.Добавьте в пробирку несколько крупинок оксида марганца (IV). Что наблюдаете? Запишите уравнение реакции с точки зрения окислительно-восстановительного процесса.
7.Внесите тлеющую лучину в пробирку с раствором пероксида водорода. Что наблюдаете? Запишите уравнение реакции.
8.В пробирку поместить кусочек мела.
9.Прилить к мрамору 4 мл раствора уксусной кислоты. Что наблюдаете? Запишите уравнение химической реакции в молекулярной и ионной форме.
10.Зажгите лучину.
11.Внесите горящую лучину в пробирку-реактор. Что наблюдаете? Заполните таблицу:
|
Опыт |
Что наблюдали |
Уравнения реакций |
Вывод
|
|
1. |
|
|
|
Содержание отчета: укажите номер лабораторного опыта, тему, цель, оборудование, выполните задания методических указаний, сформулируйте и запишите вывод.
Контрольные вопросы
1.Почему водород собирают в перевернутую пробирку?
2.Если через раствор известковой воды посредством стеклянной трубки продувать выдыхаемый воздух, то через некоторое время известковая вода помутнеет. Почему?
3.Какое свойство углекислого газа лежит в основе его применения в углекислотном огнетушителе.
Практическое занятие № 12
Наименование работы: Решение экспериментальных задач
Цель работы: применить знания о химических свойствах и способах получения соединений металлов и неметаллов для решения экспериментальных задач.
Продолжительность работы – 1 ч.
Дидактическое оснащение: пробирки, штатив для пробирок, в пробирках под номерами 1,2 и 3 кристаллические вещества: нитрат бария, сульфат натрия и карбонат кальция, сульфат железа (II), хлорида меди, гидроксид натрия,гексациано-феррат (III) калия, роданид калия, серная кислота, хлорид бария.
Задание
1.Распознайте с помощью качественных реакций нитрат бария, сульфат натрия и карбонат кальция, получите хлорид меди из оксида меди.
Краткие теоретические сведения
Распознавание веществ производится с помощью качественных реакций. Качественные реакции – это химические реакции, с помощью которых можно определить то, чем одно вещество отличается от другого по элементарному составу, иначе говоря, эти реакции позволяют определить отдельные ионы или молекулы, из которых состоит исследуемое вещество или смесь веществ. В качественном анализе применяют реакции, сопровождающиеся каким-либо эффектом, который можно легко обнаружить органами чувств:
· Изменение окраски раствора;
· Выпадение или растворение осадка;
· Выделение газов (иногда обладающих характерным запахом).
В таблице приведены некоторые из качественных реакций.
Таблица
|
Катион |
Воздействие или реактив |
Наблюдаемая реакция |
|
Na + |
Пламя |
Желтое окрашивание |
|
К + |
Пламя |
Фиолетовое окрашивание |
|
Са 2+ |
Пламя |
Кирпично-красное окрашивание |
|
Аg + |
хлорид |
Выпадение белого осадка |
|
Fe 2+ |
гексациано-феррат (III) калия (красная кровяная соль) |
Выпадение синего осадка |
|
Fe 3+ |
роданид |
Красное окрашивание |
|
Анион |
Воздействие или реактив |
Наблюдаемая реакция |
|
S04 2- |
соль бария |
Выпадение белого осадка |
|
СО3 2- |
кислота |
вскипание или пузырьки газа |
|
Cl - |
ионы Аg+ |
Выпадение белого осадка, не растворимого в HN03 |
Для выполнения опытов отбирается проба (небольшое количество вещества помещается в чистую пробирку) и исследуется реактивом.
Порядок работы
1.В выданных трех пробирках под номерами 1,2 и 3 находятся кристаллические вещества: нитрат бария, сульфат натрия и карбонат кальция. Опытным путем определите, в какой пробирке находится каждое из веществ.
2. Опытным путем получите хлорид меди из оксида меди.
3. Заполните таблицу:
Таблица
|
Опыт |
Что наблюдали |
Уравнения реакций |
Вывод
|
|
1. |
|
|
|
Содержание отчета: укажите номер лабораторного опыта, тему, цель, оборудование, выполните задания методических указаний, сформулируйте и запишите вывод.
Контрольные вопросы
1.В каких случаях проводятся качественные реакции?
2.О чем свидетельствует выпадение белого осадка в реакции между хлоридом натрия и нитратом серебра?
Лабораторная работа №13
Наименование работы: Изготовление моделей молекул органических веществ
Цель: изготовить модели молекул углеводородов, назвать изученные вещества по номенклатуре ИЮПАК; определить принадлежность веществ к определенным классам, объяснять зависимость свойств веществ от их состава и строения.
Продолжительность проведения – 1 ч.
Дидактическое оснащение: набор моделей атомов, учебник «Химия 10 класс»; Габриелян О. С., базовый уровень.
Задание
1. Собрать шаростержневые модели молекулы метана и его гомологов.
2. Собрать шаростержневые модели молекул представителей класса «Алкены».
3. Собрать шаростержневые модели молекул представителей класса «Алкины».
Краткие теоретические сведения
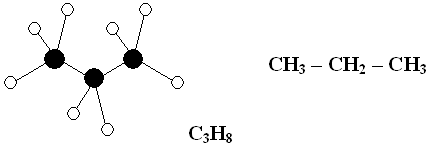
Пример. Составить модель молекулы пропана.
Молекула пропана
C3H8 содержит три атома углерода и восемь атомов
водорода. Атомы углерода соединены между собой. Суффикс – ан указывает
на наличие одинарной связи между атомами углерода. Атомы углерода располагаются
под углом 109![]() 28¢.
28¢.
Молекула имеет форму пирамиды. Атомы углерода изображены черными кругами, а атомы водорода – белыми, атомы хлора – зелеными.
При изображении моделей необходимо соблюдать соотношение размеров атомов.
Порядок работы:
1. Ознакомьтесь с главой «Краткие теоретические сведения»;
2.Выполните предложенные задания;
3. Оформите отчёт.
Содержание отчета: укажите номер лабораторного опыта, тему, цель, оборудование, выполните задания методических указаний, сформулируйте и запишите вывод.
Контрольные вопросы:
1. Почему при изготовлении моделей молекул требуются шарики разных размеров?
2. Какое из основных положений теории А.М.Бутлерова было использовано при работе?
3. Какой вид связи между «атомами углерода»?
4. Что понимается под химическим строением молекул органических соединений? Сформулировать положение теории строения, которое объясняет различие в свойствах изомеров.
Лабораторная работа №14
Наименование работы: Ознакомление с коллекцией образцов нефти и продуктов ее переработки. Ознакомление с коллекцией каучуков и образцами изделий из резины
Цель работы: ознакомление с коллекций образцов нефти и продуктов её переработки, каучуков и образцов изделий из резины.
Продолжительность работы – 1 ч.
Дидактическое оснащение: коллекция каучуков и образцов изделий из резины, пробирки 2шт., штатив, пробиркодержатель, натуральный каучук, сырая резина, бензин, корковая пробка, образцы нефти и нефтепереработки.
Задание
1.Рассмотрите выданную коллекцию с образцами каучуков и образцами изделий из резины, нефти и продуктов её переработки.
Краткие теоретические сведения
Каучук – полимер, высокомолекулярное вещество. Основа каучуков – диеновые углеводороды. По происхождению каучуки подразделяются на натуральные и синтетические.
Натуральный каучук является природным высокомолекулярным соединением растительного происхождения. Натуральный каучук получают из млечного сока (латекса) каучуконосных растений, преимущественно гевеи бразильской. В латексе содержится 20-25 % полиизопрена — полимера изопрена С5Н8, структурная формула которого
Однако бурный рост производства автомобилей поставил перед учеными всего мира задачу получения синтетического каучука.
Основные эксплуатационные свойства — эластичность и упругость в сочетании с хорошей прочностью, теплостойкостью и холодостойкостью каучуки приобретают лишь после вулканизации— превращения в резину.
Резина – эластичный материал, получаемый в процессе вулканизации каучука. В зависимости от степени вулканизации резины классифицированы на твердые, полутвердые и мягкие.
По назначению готовые резины (вулканизаты) делятся на две основные группы общего и специального назначения.
Резины общего назначения получают главным образом на основе бутадиеновых, изопреновых, хлоропреновых каучуков и их комбинаций. Эти резины работоспособны в интервале температур от 50 до 150 °С.. Их используют для изготовления шин, транспортных лент, приводных ремней, обуви и т.п.
Резины специального назначения используют для производства изделий с особыми свойствами — химически стойких, масло - и бензостойких, мороза - и теплостойких, радиационно-стойких. Кроме того, на основе некоторых видов каучуков и соответствующих наполнителей получают электропроводящие и магнитные резины, а также резины для изоляции электрических проводов и кабелей (так называемые диэлектрические резины).
В процессе вулканизации серой каучука получают резину. При вулканизации происходит сшивание макромолекул каучука «мостиками» серы. При нагревании каучук способен размягчаться, а при охлаждении – становиться хрупким. Органические растворители, действующие на каучук, размягчают его и вызывают разбухание. Резина устойчива к растворителям, она сохраняет упругость при высоких и низких температурных режимах.
Сравнение каучука и резины
В чем разница между резиной и каучуком? Прежде всего, резина и каучук различаются количественным составом, а значит и свойствами. Чтобы получить резину из каучука, в него вводят ускорители (оксиды магния и свинца, полисульфиды), агенты (серу, перкиси и селен), мягчители и противостарители, активные и неактивные наполнители, пластификаторы и прочие добавки с определенным назначением, улучшающие качественные характеристики материала.
Каучук – сшитый полимер, способный распрямляться и обратно сворачиваться при действии разных механических нагрузок и при растяжении. Резина – сшитые макромолекулы, не способные плавиться при нагревании и кристаллизоваться при охлаждении.
Резина в отличие от каучуков наиболее универсальный материал. Она сохраняет физические и механические свойства в широком температурном диапазоне. Ее свойства, прежде всего, зависят от вида каучука, идущего для производства. Для резины характерна способность к существенным деформациям, высокая эластичность и теплостойкость, малая сжимаемость, химическая стойкость, повышенная износостойкость, водонепроницаемость и небольшая плотность.
Каучук, взаимодействуя с кислородом и иными окисляющими реагентами, быстро стареет. При высоких температурах разлагается, а при низких, утрачивая пластичность, приобретает хрупкость.
Отличие каучука и резины
1.Высокие и низкие температуры не способны ухудшать эластичность резины – самую важную ее характеристику.
2.Резина не боится деформации, влаги, воздействия агрессивных химических реагентов.
Характеристика основных нефтяных продуктов
Газолин (петролейный эфир) - смесь легких углеводородов (пентанов и гексанов), бесцветная жидкость, кипящая в интервале температур от 40 до 70°С, применяется, как растворитель жиров, масел, смол и др.
Бензин – легкая, подвижная, бесцветная прозрачная жидкость с характерным запахом, легко воспламеняющаяся. Наибольшее применение – в качестве моторного топлива для авиационных и автомобильных двигателей. В зависимости от своего назначения бензины выпускают разных сортов. Для каждого сорта бензина характерной является температура начало и конца кипения:
- авиационные бензины: начальную не ниже 40°С, конечную 150-180°С;
- автомобильные бензины имеют начальную температуру кипения не ниже 40°С, а конечную 200-250°С,
- бензины, для растворения жиров масел и т.д. имеют температуру кипения от 80 до 120°С.
Лигроин – прозрачная, легкая воспламеняющаяся жидкость, отгоняется при температуре 110-240°С. Это промежуточная фракция между бензиновой и керосиновой. Используется как тракторное топливо.
Керосин – прозрачная, бесцветная или желтоватая жидкость, легче воды. Представляет смесь жидких углеводородов, кипит в пределах температур 150-315°С.
Различают керосин прямой перегонки нефти и крекинг-керосин, который получают крекингом мазута. Применяют как топливо для тракторных двигателей, в том числе для карбюраторных тракторных двигателей, и для бытовых нужд.
Газойль, соляр – дизельные топлива для быстроходных и среднеходных дизелей.
Мазут – остаток после отгонки из нефти светлых фракций, темная вязкая жидкость. При дальнейшей перегонке получают множество ценных продуктов
Смазочные масла – высококипящие вязкие фракции, которые получают из мазута при его переработке по масляному варианту.
Вазелин – смесь жидких и твердых углеводородов. Получают из мазута путем перегонки с водяным паром. Плавится при температурах 37-50°С.
Применяют для пропитки бумаги и тканей, в электротехнической промышленности, для смазки подшипников и приготовления специальных смазок, для зашиты металлов от коррозии, в медицине, в косметике.
Парафин – смесь твердых насыщенных высокомолекулярных углеводородов. Белая или желтоватая масса. Температура плавления 50-70°С. Устойчив к действию кислот, щелочей, окислителей.
Применяют в бумажной, текстильной, полиграфической, кожевенной, спичечной промышленности, в медицине, в быту - для изготовления свечей.
Гудрон – черная смолистая масса. Применяется в дорожном строительстве, а также для смазывания грубых механизмов, изготовления колесной мази.
Бензол, толуол – ароматические углеводороды.
Бензол – легкокипящая, бесцветная, нерастворимая в воде жидкость со своеобразным запахом. Используют в качестве ароматического компонента авиационных бензинов и как растворитель в производстве авиационных масел.
Толуол – бесцветная прозрачная жидкость со специфическим запахом, кипит при температуре 110°С.
Присутствие бензина в моторном топливе повышает его антидетонационные свойства. Используется в производстве взрывчатых веществ, сахаринов, в качестве растворителей лаков, красок.
В природе встречаются отдельные залежи твердых парафиновых углеводородов в виде горного воска (озокерит). По внешнему виду он напоминает пчелиный воск, имеет запах керосина. Очищенный воск называется церезин. Его применяют как электроизоляционный материал, для приготовления различных смазок и мазей для технических и медицинских нужд.
Нефтяные газы – смесь различных газообразных углеводородов, растворенных в нефти. Они выделяются в процессе её добычи. К ним также относят газы крекинга нефтепродуктов. Их применяют как топливо и для получения различных химических веществ, таких как искусственный каучук, пластмассы и др.
Химическиеспособы переработки нефти
1. Крекинг – один из основных приёмов переработки нефтепродуктов. Это процесс расщепления высших углеводов (с длинной цепью) на углеводороды с меньшей молекулярной массой. Он сопровождается изомеризацией:
А. Термический крекинг – процесс ведут при температуре 450-550 0С и давлении от 7 до 35 атмосфер или в несколько мега паскалей.
Б. Пиролиз – высокотемпературный крекинг. Процесс ведут при температуре 650-750 0С. Его осуществляют для получения газообразных непредельных углеводородов. Наряду с газами притоком крекинге образуются жидкие ароматические соединения ароматизация нефти.
В. Католический крекинг - процесс разложения углеводородов под действия катализатора – природных алюмосиликатов. Процесс ведут при температуре 450-500 0С. Главное преимущество католического крекинга – большой выход бензинов и их высокое октановое число и более ценный состав газов крекинга (больше пропана и бутана меньше метана этана)
При католическом крекинге требуется периодическая регенерация катализатора.
2. Риформинг – технический процесс каталитического облагораживания низко октановых бензинов. Риформинг проводится с применением платинового катализатора. Вследствие образования при этом ароматических углеводородов значительно вырастает октановое число горючего.
Порядок работы
1.Вырежьте из не вулканизированного каучука и резины тонкие полоски одинакового сечения и равной длины. Растяните их и затем отпустите. Какой образец быстрее возвращается в прежнее состояние и является, следовательно, более эластичным?
Попытайтесь теперь растягивать полоски до разрыва их. Что прочнее: каучук или резина?
2.Налейте в две пробирки по 2-3 мл бензина. В одну из пробирок поместите кусочек не вулканизированного каучука, а в другую – таких же размеров кусочек резины. Закройте пробирки корковыми пробками и оставьте до следующего занятия.Какие изменения произошли с каучуком и резиной? Чем объясняется различие в растворимости каучука и резины?
3. Заполните таблицу:
Таблица «Сравнение образцов каучуков и изделий из резины»
|
Название образцов |
Сходство и различия |
Свойства |
|
|
|
|
|
|
|
|
|
|
|
|
4. Заполнить таблицу 1 и 2.
Таблица 1 «Нефть»
|
|
Нефть |
|
1. Агрегатное состояние и состав |
|
|
2. Запасы |
|
|
3. Переработка |
|
|
4. Применение |
|
Таблица 2 «Продукты переработки нефти»
|
Название фракции |
Состав |
Температура кипения |
Применение |
|
Ректификационные газы |
|
|
|
|
Газолиновая фракция (бензин) |
|
|
|
|
Лигроиновая фракция |
|
|
|
|
Керосиновая фракция |
|
|
|
|
Дизельное топливо |
|
|
|
|
Мазут |
|
|
|
|
Гудрон |
|
|
|
Содержание отчета: укажите номер лабораторного опыта, тему, цель, оборудование, выполните задания методических указаний, сформулируйте и запишите вывод.
Контрольные вопросы
1.Объяснить, почему все нефтепродукты (кроме мазута) называют светлыми?
2.Записать формулы углеводородов, образующих фракции светлых нефтепродуктов.
3.Какие физические процессы лежат в основе их получения?
4.Какие процессы лежат в основе получения смазочных масел?
5.Записать определение нефти. Описать физические свойства неф
Лабораторная работа №15
Наименование работы: Растворение глицерина в воде и взаимодействие с гидроксидом меди (II). Свойства уксусной кислоты, общие со свойствами минеральных кислот. Доказательство непредельного характера жидкого жира. Взаимодействие глюкозы и сахарозы с гидроксидом меди (II). Качественная реакция на крахмал.
Цель работы: изучить химические свойства кислородсодержащих органических соединений.
Продолжительность работы – 1 ч.
Дидактическое оснащение: штатив с пробирками, спиртовка; раствор уксусной кислоты (5-6%), раствор гидроксида натрия (5%), индикаторы (лакмус или метилоранж); гранулы цинка, кусочки мрамора, штатив с пробирками (4 шт.), пипетки (4 шт.), стеклянная палочка; дистиллированная вода; глицерин, этиловый спирт, растворы сульфата меди (II) (2%), и гидроксида натрия (10%), крахмал (или крахмальный клейстер), спиртовой раствор йода, картофель, белый хлеб, зеленое яблоко, растительное масло, бараний (говяжий жир), бромная вода и розовый подкисленный раствор перманганата калия.
Задание
1. Исследуйте растворимость глицерина в воде.
2. Проведите реакцию глицерина с гидроксидом меди (II).
3.Исследовать химические свойства уксусной кислоты в сравнении со свойствами минеральных (неорганических) кислот.
4. Проведите качественную реакцию на крахмал.
5. Определите отношение жиров к бромной воде и раствору перманганата калия.
Краткие теоретические сведения
Многоатомные спирты – это органические соединения, в молекулах которых содержатся две или более гидроксильных групп, соединенных с углеводородным радикалом.
Группы ОН в многоатомных спиртах размещаются у разных атомов углерода:
Соединения с двумя группами ОН при одном атоме углерода неустойчивые. Они отщепляют воду и превращаются в альдегиды:
Соединения с двумя группами ОН при соседних атомах углерода называют гликолями (или диолами).
Этиленгликоль и глицерин подобны одноатомным спиртам.
Так, они реагируют с активными металлами:
Многоатомные спирты в реакции с галогенводородами обменивают одну или несколько гидроксильных групп ОН на атомы галогена:
Глицерин взаимодействует сазотнойкислотойс образованием сложных эфиров. В зависимости от условий реакции (мольного соотношения реагентов, концентрации катализатора – серной кислоты и температуры) получаются моно, ди- и тринитроглицериды:
Качественная реакция многоатомных спиртов, позволяющая отличить соединения этого класса, – взаимодействие со свежеприготовленным гидроксидом меди(II). В щелочной среде при достаточной концентрации глицерина голубой осадок Cu(OH)2 растворяется с образованием раствора ярко-синего цвета – гликолята меди(II):
Глицерин имеет широкое применение. Благодаря гигроскопичности он используется в парфюмерии и фармации как смягчающее средство, основа для мазей, добавка к мылу. В пищевой промышленности — как добавка к напиткам. В кожевенном производстве и текстильной промышленности глицерин используют для обработки пряжи и кожи, чтобы придать им мягкости, эластичности.
Глицерин применяют для производства синтетических смол и взрывчатых веществ, например, нитроглицерина. Нитроглицерин используется для изготовления динамита. Спиртовой раствор нитроглицерина обладает сосудорасширяющим действием. Его используют как лекарство при заболевании сердца.Карбоновыми кислотами называются органические вещества, содержащие одну или несколько карбоксильных групп – СООН.
Химические свойства.
1 при диссоциации образуют ионы водорода:
R ─COOH → R─COO- + H+
2 реагируют с активными металлами и их оксидами, со щелочами:
2СН3СООН + 2К = 2СН3СООК + Н2
СН3СООН + КОН = СН3СООК + Н2О
3 взаимодействуют со спиртами с образованием сложных эфиров.
Растворы как уксусной, так и минеральных кислот одинаково изменяют окраску индикаторов, реагируют с металлами, расположенными в ряду напряжений металлов до водорода, с оксидами и гидроксидами металлов, с солями, образованными менее активными кислотами (например, угольной). Это сходство объясняется тем, что их диссоциация приводит к накоплению в растворе ионов водорода (гидроксония).
Жиры- сложные эфиры трёхатомного спирта - глицерина и высших карбоновых кислот. Всежиры животного происхождения- твёрдые вещества. Исключение лишь составляет рыбий жир.
Растительный жидкий жир
Жиры растительного происхождения- жидкие вещества, исключение составляет твёрдое кокосовое масло.
Междурастительными и животными жирамиимеется существенное различие. Так, в составжидкого жиравходят непредельные кислоты, а в составтвёрдого жира- предельные. Например,жидкий жир- содержит олеиновую кислоту C17H33COOH или линолевую кислоту C17H31COOH.
Твёрдый жирсодержит, например, пальмитиновую кислоту C15H31COOH или стеариновую кислоту C17H35COOH.
Как уже говорилось,жиры и маслапринадлежат к классу сложных эфиров. Жиры вместе с белками и углеводами составляют группу органических соединений, имеющих исключительное физиологическое значение: они являются важнейшей частью пищи!
Жиры важны и в техническом отношении: они являются источником получения глицерина, высших карбоновых кислот и мыла. Некоторыерастительные жиры и маслаиспользуются при изготовлении олифы, линолеума,масляных красокилаков. Некоторые жиры, благодаря своей большой вязкости, могут служить смазочным материалом.Жиры состоят из разнообразных кислот. Удалось выделить кислоты от С4до С24, как предельные, так и непредельные. Так, к важнейшим предельным кислотам, выделенным из жиров, является стеариновая, капроновая, каприловая, каприновая, масляная. К непредельным - олеиновая, линолевая, линоленовая.
Твёрдый жир
В природе встречаются какжидкие, так итвёрдые жиры. Но те и другие образованы одним и тем же спиртом. Несложно догадаться, что за агрегатное состояние жиров отвечают входящие в его состав кислоты (предельные - для твёрдых жиров, непредельные - для жидких).
Растительные жиры-масла, как правило жидкие, но среди них встречаются и твёрдые (пальмовое и кокосовое масло).Животные жиры- сало, преимущественно твёрдые и имеют различную температуру плавления. Температура застывания жиров всегда ниже температуры их плавления.
Порядок работы
1.Налейте в пробирку с 0,5 мл глицерина пипеткой добавьте воду (1-2 мл) небольшими порциями и палочкой перемешайте содержимое.
2.Исследуйте растворимость в воде этилового спирта. Сравните процесс растворения глицерина и этилового спирта.
3.Полученные растворы используйте в опыте 2.
4.В пробирку прилейте 2 мл раствора щелочи, затем добавьте несколько капель раствора сульфата меди (II).Какое вещество выпало в осадок? Составьте полное и сокращенное ионные уравнения реакции.
5.К смеси со свежеприготовленным осадком гидроксида меди(II) прилейте примерно 2 мл раствора глицерина. Перемешайте смесь.
Что вы наблюдаете? Отметьте, что эта реакция является характерной реакцией на многоатомные спирты, запомните методику ее выполнения.
6.Возьмите четыре чистые пробирки и налейте в каждую 1-2 мл раствора соляной кислоты, добавьте:
а) в первую пробирку добавьте несколько капель лакмуса (отметьте изменение окраски), затем нейтрализуйте кислоту раствором щелочи;
б) во вторую пробирку поместите 1-2 гранулы цинка (если не происходит никаких изменений, то слегка нагрейте пробирку на пламени спиртовки);
в) в третью пробирку добавьте кусочек оксида меди и наблюдайте за изменением цвета раствора;
г) в четвертую пробирку внесите 1-2 мл раствора карбоната натрия. Обратите внимание на признаки химической реакции.
7.Возьмите другие четыре чистые пробирки и налейте в каждую 1-2 мл раствора уксусной кислоты, повторите пункты а-г из первого пункта.
8. Заполните таблицу 1 и 2:
Таблица 1 «Свойства минеральных кислот на примере соляной кислоты»
|
Опыт n/n |
Свойства минеральных кислот |
Реагент |
Уравнения реакций в молекулярном и ионном виде |
Признаки химических реакций |
|
1. |
Диссоциация |
|
|
|
|
2. |
Взаимодействие со щелочами |
|
|
|
|
3. |
Взаимодействие с металлами |
|
|
|
|
4. |
Взаимодействие с основными оксидами |
|
|
|
|
5. |
Взаимодействие с солями менее активных кислот |
|
|
|
Таблица 2 «Свойства органических кислот на примере уксусной кислоты»
|
Опыт n/n |
Свойства органических кислот |
Реагент |
Уравнения реакций в молекулярном и ионном виде |
Признаки химических реакций |
|
1. |
Диссоциация |
|
|
|
|
2. |
Взаимодействие со щелочами |
|
|
|
|
3. |
Взаимодействие с металлами |
|
|
|
|
4. |
Взаимодействие с основными оксидами |
|
|
|
|
5. |
Взаимодействие с солями менее активных кислот |
|
|
|
9. Насыпьте в пробирку немного крахмала, прилейте воды и хорошо взболтайте.
10.Вылейте смесь медленно при помешивании в заранее подготовленную в стаканчике горячую воду и прокипятите ее.
11.Полученный коллоидный раствор — крахмальный клейстер — используйте для следующего опыта.
12.К 0,5-1 мл крахмального клейстера в пробирке добавьте каплю спиртового раствора йода. Что наблюдаете?
13.Нагрейте полученную смесь крахмального клейстера с йодом. Какие изменения происходят? Восстанавливается ли прежняя окраска при охлаждении?
14.Нанесите несколько капель спиртового раствора йода на кусочек хлеба и на срез клубня картофеля, яблока. Что вы наблюдаете? Заполните таблицу:
|
Опыт № |
Испытываемый продукт (вещество) |
Действия |
Наблюдения |
Выводы |
|
1. |
|
|
|
|
15. В две пробирки поместить по 1 мл растительного масла, в другие две
примерно по 1 г твердого жира (перед добавлением других веществ пробирки с твердым жиром поместите в теплую баню).
16.В первую пару пробирок с разными жирами добавить бромную воду, во вторую пару пробирок добавить раствор перманганата калия. Закройте пробирки пробками и сильно встряхните. Если ни в одной из пробирок не происходит изменений, аккуратно нагрейте их при невысокой температуре. Для нагревания используйте водяную баню. Что вы наблюдаете? Заполните таблицу:
Таблица «Доказательство непредельного характера жидкого жира»
|
Исследуемое вещество |
Наблюдаемые явления |
Выводы |
|
|
Бромная вода |
Раствор перманганата калия |
||
|
Растительное масло |
|
|
|
|
Бараний (говяжий) жир |
|
|
|
Содержание отчета: укажите номер лабораторного опыта, тему, цель, оборудование, выполните задания методических указаний, сформулируйте и запишите вывод.
Контрольные вопросы
1.Что можно сказать о растворимости глицерина в воде?
2.Почему глицерин имеет высокую вязкость?
3.Почему глицерин взаимодействует с гидроксидом меди (II)?
4.Зависят ли результаты наблюдений от того, свойства какой кислоты вы исследовали?
5.Что общего в составе исследуемых кислот?
6.Почему для муравьиной кислоты характерна реакция «серебряного зеркала», а другие карбоновые кислоты не обладают таким свойством? Напишите уравнение соответствующей реакции.
Лабораторная работа №16
Наименование работы: Растворение белков в воде. Обнаружение белков в молоке и мясном бульоне. Денатурация раствора белка куриного яйца спиртом, растворами солей тяжелых металлов и при нагревании
Цель работы: изучить свойства белков: растворение белков, отношение белков к нагреванию и действию растворов тяжелых металлов и спирта.
Дидактическое оснащение: две колбы (200 мл), марля, воронка, пробирки (4 шт.), пробиркодержатель, спиртовка, спички; яйцо, растворы сульфата меди (II) (1%) и ацетата свинца (II) (5%), хлорид натрия (крист.), этиловый спирт, дистиллированная вода яичный белок, дистиллированная вода, раствор хлористого калия; кератин (шерсти или волос), мясной фарш, молоко, раствор щелочи, раствор сульфата меди (II).
Задание
1. Исследуйте растворимость белка.
2.Провестиденатурацию раствора белка при нагревании, при действии тяжелых металлов и
спирта.
3. Обнаружить присутствие белка в продуктах питания.
Краткие теоретические сведения
Белками или белковыми веществами, называют высокомолекулярные природные полимеры, молекулы которых построены из остатков аминокислот, соединенных амидной (пептидной) связью. Белки - амфотерные электролиты. При определенном значении рН среды число положительных и отрицательных зарядов в молекуле белка одинаково. Это одно из основных свойств белка. Под действием внешних факторов (температуры, механического воздействия, действия химических агентов) происходит изменение вторичной, третичной и четвертичной структур белковой макромолекулы. Первичная структура, а следовательно, и химический состав белка не меняется.
Растворимость белков: многие белки растворяются в воде, что обусловлено наличием на поверхности белковой молекулы свободных гидрофильных групп. Растворимость белка в воде зависит от структуры белка, реакции среды, присутствия электролитов. В кислой среде лучше растворяются белки, для которых характерны кислотные свойства, а в щелочной – белки, обладающие основными свойствами. Белки – природные полипептиды с огромной молекулярной массой. Они входят в состав всех живых организмов и выполняют различные биологические функции.
Белки являются термолабильными соединениями и при нагревании свыше 50-60°С наступает денатурация. Сущность тепловой денатурации заключается в развертывании специфической структуры полипептидной цепи и разрушении гидратной оболочки белковых молекул, что проявляется заметным уменьшением их растворимости. Наиболее полное и быстрое осаждение происходит в изоэлектрической точке, т.е. при таком значении рН среды, когда суммарный заряд белковой молекулы равен нулю, поскольку при этом частицы белка наименее устойчивы.
Важнейшим свойством белков является их способность проявлять как кислые, так и основные свойства, то есть выступать в роли амфотерных электролитов. Это обеспечивается за счет различных диссоциирующих группировок, входящих в состав радикалов аминокислот. Например, кислотные свойства белку придают карбоксильные группы аспарагиновой и глутаминовой аминокислот, а щелочные — радикалы аргинина, лизина и гистидина. Чем больше дикарбоновых аминокислот содержится в белке, тем сильнее проявляются его кислотные свойства и наоборот.
Белки, обладающие кислыми свойствами, осаждаются в слабокислой среде, а белки с основными свойствами – в слабощелочной. В сильнокислых или сильнощелочных растворах денатурированный при нагревании белок в осадок не выпадает, так как частицы его перезаряжаются и несут в первом случае положительный, а во втором отрицательный заряд, что повышает их устойчивость в растворе.
Белки – природные полипептиды с огромной молекулярной массой. Они входят в состав всех живых организмов и выполняют различные биологические функции.
Физические свойства белка.
Физические свойства белка определяются строением, поэтому белки делят наглобулярные(растворимые вводе) и фибриллярные(нерастворимые в воде).
Химические свойства белков.
1.Денатурация белка(разрушение вторичной и третичной структуры с сохранением первичной). Пример денатурации – свертывание яичных белков при варке яиц.
2.Гидролиз белков– необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот. Так можно установить количественный состав белков.
3. Качественные реакции:
Биуретовая реакция– взаимодействие пептидной связи и солеймеди(II) в щелочном растворе. По окончанию реакции раствор окрашивается в фиолетовый цвет.
Ксантопротеиновая реакция- при реакции с азотной кислотой наблюдается желтое окрашивание.
Биологическое значение белка.
1.Белки – строительный материал, из него построены мышцы, кости, ткани.
2.Белки - рецепторы. Передают и воспринимают сигнал, поступающих от соседних клеток из окружающей среды.
3.Белки играют важную роль в иммунной системе организма.
4.Белки выполняют транспортные функции и переносят молекулы или ионы вместо синтеза или накопления. (Гемоглобин переносит кислород к тканям.)
5.Белки – катализаторы – ферменты. Это очень мощные селективные катализаторы, которые ускоряют реакции в миллионы раз.Есть ряд аминокислот, которые не могут синтезироваться в организме - незаменимые, их получают только с пищей: тизин, фенилаланин, метинин, валин, лейцин, триптофан, изолейцин, треонин.
Порядок работы
1.К 2 каплям неразведенного яичного белка прибавляют 1 мл дистиллированной воды и перемешивают. При этом яичный альбумин растворяется, а яичный глобулин выпадает в виде небольшого осадка.
2.К 2 каплям яичного белка прибавляют 1 мл 5%-го раствора хлорида калия. Что наблюдаете?
3.Проверяют растворимость в воде и 5% растворе хлористого калия белка кератина, содержащегося в шерсти и волосах. Что наблюдаете? Заполните таблицу:
Таблица «Растворимость белка»
|
Опыт № |
Название белка |
Растворимость в воде |
Растворимость в 5% КСl |
|
1. |
|
|
|
4.В пробирку поместите 1 мл раствора белка и осторожно нагревайте над пламенем спиртовки. Осадок появляется еще до закипания раствора. Охладите содержимое пробирки. Разбавьте водой в 2 раза. Почему раствор белка при нагревании мутнеет?
Почему образующийся при нагревании осадок не растворяется при охлаждении и разбавлении водой
5.В две пробирки поместите по 1 мл раствора белка. В первую пробирку добавьте несколько капель раствора сульфата меди (II), во вторую — раствор ацетата свинца (II). Наблюдайте образование труднорастворимых солеобразных соединений белка. Данный опыт иллюстрирует применение белка как противоядие при отравлении солями тяжелых металлов.
6.К 1 мл раствора белка добавьте немного (на кончике шпателя) кристаллов хлорида натрия, затем 5-6 мл этилового спирта. Что наблюдаете?
7. Заполните таблицу:
Таблица «Отношение белков к нагреванию и действию растворов тяжелых металлов и спирта»
|
Опыт № |
Действия |
Наблюдения |
Выводы |
|
1. |
|
|
|
|
2. |
|
|
|
|
3. |
|
|
|
8. В чистую пробирку поместите 1 г фарша, прилейте на одну треть пробирки воды и прокипятите в течение нескольких минут. Что происходит? Отлейте в чистую пробирку 1,5-2 мл бульона, разбавьте равным объемом раствора щелочи и прибавьте 4-5 капель раствора сульфата меди (II). Отметьте наблюдения.
9.В чистую пробирку налейте 1 мл молока, прибавьте туда 2 мл раствора щелочи и 4-5 капель раствора сульфата меди. Что наблюдаете?
10.В чистую пробирку налейте 3 мл молока, добавьте несколько капель азотной кислоты и прокипятите. Что происходит? Заполните таблицу:
Таблица «Обнаружение белка в продуктах»
|
Опыт № |
Испытываемый продукт(вещество) |
Действия |
Наблюдения |
Выводы |
|
|
|
|
|
|
Содержание отчета: укажите номер лабораторного опыта, тему, цель, оборудование, выполните задания методических указаний, сформулируйте и запишите вывод.
Контрольные вопросы
1.Перечислите химические элементы, входящие в состав белковой молекулы.
2.Что называют первичной структурой белка? Как она образуется?
3.Как образуется вторичная структура белка? С помощью, каких связей она поддерживается?
4.За счет, каких взаимодействий реализуется третичная структура белка? Каково ее биологическое значение
5.Что такое денатурация? Какие вещества и явления приводят к денатурации белка? Почему?
Практическое занятие № 17
Наименование работы: Решение экспериментальных задач на идентификацию органических соединений
Цель работы: научиться самостоятельно, составлять план проведения опытов и осуществлять экспериментально-исследовательскую деятельность по идентификации органических соединений.
Продолжительность работы – 2 ч.
Дидактическое оснащение: штатив с пронумерованными пробирками, газовая горелка (или спиртовка); водный раствор NaOH, растворы H2S04.,Na2CO3, KMnO4, бромная вода, раствор CuS04 , аммиачный раствор оксида серебра, вода.
Задание
1.Определите выданные вам вещества.
Краткие теоретические сведения
Практически каждое органическое вещество можно определить с помощью характерных реакций. Эти реакции называются качественные.
Принадлежность органического вещества к определенным классам соединений, их строение, степень чистоты устанавливаются с помощью элементного и функционального анализа. Качественный элементный анализ позволяет определить качественный состав молекул органического соединения; количественный элементный анализ устанавливает элементный состав соединения и простейшую формулу.
Структура органического соединения может считаться окончательно доказанной, если осуществлен встречный синтез; проведен систематический химический анализ, включающий в себя: предварительные испытания, качественные реакции на функциональные и нефункциональные группы, получены различные производные; проведены спектральные методы анализа.
Вследствие этого, прежде чем выполнить основную задачу по идентификации, заключающуюся в определении строения полифункционального органического вещества или идентификации компонентов бинарной смеси, целесообразно отработать методы обнаружения функциональных групп (качественные реакции, характеристические частоты поглощения в ИК- спектрах, УФ- и ЯМР- спектры), получения и очистки функциональных производных каждого из пяти важнейших классов органических соединений (спирты, фенолы, альдегиды или кетоны, карбоновые кислоты и амины).
Функциональный анализ и идентификация органических веществ начинаются с предварительных испытаний, включающих в себя: определение физических констант, пробу на сожжение, растворимость в воде и органических растворителях, качественный анализ. Принадлежность к классам органических веществ можно установить по их отношению к реагентам
Порядок работы
1.В вашем распоряжении имеется газовая горелка (или спиртовка) и набор реактивов:
- Водный раствор NaOH.
- Раствор H2S04
- Раствор Na2CO3
- Раствор KMnO4
- Бромная вода.
- Раствор CuS04
- Аммиачный раствор оксида серебра.
- Вода.
Внимательно ознакомьтесь с ними.
2. C помощью минимального числа реагентов, определите содержимое в каждой паре пробирок.
I вариант: а) бензойная кислота; б) анилин;
II вариант: а) глюкоза; б) бензойная кислота;
III вариант: а) формалин; б) этиловый спирт;
IV вариант: а) глюкоза; б) сахароза;
V вариант: а) уксусная кислота; б) этиловый спирт;
VI вариант: а) глюкоза; б) глицерин.
Содержание отчета: укажите номер лабораторного опыта, тему, цель, оборудование, выполните задания методических указаний, сформулируйте и запишите вывод.
Контрольные вопросы
1.Какие реагенты используются для определения разных классов? Приведите примеры.
2.Какие меры предосторожности необходимо соблюдать при работе с формалином?
3.По каким другим признакам, кроме качественных реакций, можно распознать предложенные пары веществ?
Практическое занятие № 18
Наименование работы: Распознавание пластмасс и волокон
Цель работы: научиться распознавать пластмассы и волокна.
Продолжительность проведения – 1ч.
Дидактическое оснащение: штатив с пробирками, стеклянные трубки, пинцет, пробирочные зажимы, ножницы; образцы пластмасс и волокон в пронумерованных пакетах, ацетон, раствор NaOH (10%), кислоты: H2S04 (конц.), HNO3 (конц.)
Задание
1. Распознать пластмассы.
2. Распознать волокна.
Краткие теоретические сведения
Полимеры(от греч. polymeres - состоящий из многих частей, многообразный), химические соединения с высокой молекулярной массой (от нескольких тысяч до многих миллионов), молекулы которых (макромолекулы) состоят из большого числа повторяющихся группировок (мономерных звеньев). Атомы, входящие в состав макромолекул, соединены друг с другом силами главных и (или) координационных валентностей.
Пластические массы,пластмассы, пластики, материалы, содержащие в своём составе полимер, который в период формования изделий находится в вязкотекучем или высокоэластичном состоянии, а при эксплуатации — в стеклообразном или кристаллическом состоянии. В зависимости от характера процессов, сопутствующих формованию изделий, Пластмассы делят на реактопласты и термопласты. К числу реактопластов относят материалы, переработка в изделия которых сопровождается химической реакцией образования сетчатого полимера — отверждением; при этом пластик необратимо утрачивает способность переходить в вязкотекучее состояние (раствор или расплав). При формовании изделий из термопластов не происходит отверждения, и материал в изделии сохраняет способность вновь переходить в вязкотекучее состояние.
Волокна растительного происхождения Хлопок
Хлопок, волокна, покрывающие семена хлопчатника. При его созревании плоды (коробочки) раскрываются, и из них собирают т. н. хлопок-сырец (волокно с неотделенными семенами). При переработке от семян отделяют хлопок-волокно (волокна длиной более 20 мм), пух (менее 20 мм) и подпушек (менее 5 мм). Из хлопка вырабатывают ткани, трикотаж, нити, вату и др. Пух и подпушек хлопка применяют в химической промышленности как сырье для изготовления искусственного волокна и нитей, пленки, лаков и т. п.
Лен
Наибольшие посевные площади льна-долгунца — в европейских странах, а также в Египте, Турции и др., льна масличного — в Индии, Аргентине, США.
Пенька
Пенька, грубое лубяное волокно, полученное из стеблей конопли. Из пеньки делают канаты, веревки, шпагат и т. п.
Волокна животного происхождения
Шерсть-волосяной покров животных (овец, коз, верблюдов и др.). Основную массу перерабатываемой в промышленности шерсти составляет овечья. Виды волокон шерсти: пух (наиболее ценное тонкое, мягкое извитое волокно), переходный волос, ость (более толстое, жесткое и менее извитое, чем пух, волокно) и «мертвый волос» (малопрочный и жесткий). Из шерсти вырабатывают пряжу, ткани, трикотаж, валяльно-войлочные изделия и др.
Свойства некоторых пластмасс и волокон.
Полиэтилен. Полупрозрачный, эластичный, жирный на ощупь материал. При нагревании размягчается, из расплава можно вытянуть нити. Горит синеватым пламенем, распространяя запах расплавленного парафина, продолжает гореть вне пламени.
Поливинилхлорид. Эластичный или жесткий материал, при нагревании быстро размягчается, разлагается с выделением хлороводорода. Горит коптящим пламенем, вне пламени не горит.
Полистирол. Может быть прозрачным и непрозрачным, часто хрупок. При нагревании размягчается, из расплава легко вытянуть нити. Горит коптящим пламенем, распространяя запах стирола, продолжает гореть вне пламени.
Полиметилметакрилат. Обычно прозрачен, может иметь различную окраску. При нагревании размягчается, нити не вытягиваются. Горит желтоватым пламенем с синей каймой и характерным потрескиванием, распространяя эфирный запах.
Фенолформальдегидная пластмасса. Темных тонов (от коричневого до черного). При нагревании разлагается. Загорается с трудом, распространяя запах фенола, вне пламени постепенно гаснет.
Хлопок. Горит быстро, распространяя запах жженой бумаги, после сгорания остается серый пепел.
Шерсть, натуральный шелк. Горит медленно, с запахом жженых перьев, после сгорания образуется черный шарик, при растирании превращающийся в порошок.
Ацетатное волокно. Горит быстро, образуя нехрупкий, спекшийся шарик темно-бурого цвета. В отличие от других волокон растворяется в ацетоне.
Капрон. При нагревании размягчается, затем плавится, из расплава можно вытянуть нити. Горит, распространяя неприятный запах.
Лавсан. При нагревании плавится, из расплава можно вытянуть нити. Горит коптящим пламенем с образованием темного блестящего шарика.
Порядок работы
1.Внимательно рассмотрите выданные четыре пакетика с образцами пластмасс.
2.Распознавание пластмасс начните с их сжигания, которое проводите несколько раз. При этом проследите:
а) с какой скоростью происходит горение;
б) каков запах продуктов горения;
в) какой характер имеет остаток после сгорания.
Этим опытом вы установите принадлежность пластмасс. Внимание! Сжигать пластмассу и волокно над подставкой железного штатива, над лотком для оборудования или над металлическим листом!
3.Отметьте действие продуктов горения или разложения на индикатор.Проверьте действие кислот, щелочей и ацетона на пластмассы.
4.Распознавание волокон начните с их сжигания, которое проводите несколько раз. При этом проследите:
а) с какой скоростью происходит горение;
б) каков запах продуктов горения;
в) какой характер имеет остаток после сгорания.
Этим опытом вы установите принадлежность волокна к определенной группе: целлюлозным, белковым, синтетическим.
5.Отметьте действие продуктов горения или разложения на индикатор.Проверьте действие кислот, щелочей и ацетона на волокна.
6. По итогам проведенных опытов заполните таблицы 1 и 2, сравнивая результаты испытаний со справочными данными.
Таблица 1 «Распознавание пластмасс»
|
Исследуемый образец |
Внешние признаки |
Отношение к нагреванию |
Характер горения |
Растворимость в органических растворителях |
Выводы |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 2 «Распознавание волокон»
|
Исследуемый образец |
Отношение к нагреванию |
Характер горения, (скорость горения, запах, остаток) |
Отношение к концентрированным кислотам и щелочам |
Растворимость в органических растворителях |
Выводы |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
Содержание отчета: укажите номер лабораторного опыта, тему, цель, оборудование, выполните задания методических указаний, сформулируйте и запишите вывод.
Контрольные вопросы
1.Какие вещества называют полимерами?
2.Какие полимеры называют термопластичными, а какие термореактивными? Приведите примеры.
3.Почему полиэтилен не действует на бромную воду, а полистирол ее обесцвечивает?
4.Какие основные виды волокон вам известны? Приведите примеры.
5.Чем отличаются искусственные волокна от синтетических?
4. Литература, информационное обеспечение
1.Габриелян О.С. Химия: учеб. для студ. проф. учеб. заведений /О.С. Габриелян, И.Г. Остроумов. -М.,2012
2.Хомченко И.Г. Общая химия: учеб. для студ. проф. учеб. заведений –М., 2014
3.Габриелян О.С. Химия. 10 класс. Базовый уровень: учеб.дляобщеобразоват. учреждений.- М.,2013
4.Габриелян О.С. Химия. 11 класс. Базовый уровень: учеб.дляобщеобразоват. учреждений.- М.,2014
5.Критерии оценивания лабораторных и практических работ
Отметка «5» ставится в том случае, если студент:
- выполнил работу в полном объеме с соблюдением необходимой последовательности;
- в представленном отчете правильно и аккуратно выполнил все задания, таблицы и сделал необходимые выводы.
Отметка «4» ставится в том случае, если выполнены требования к оценке «5», но:
- было допущено не более одной негрубой ошибки и одного недочета;
- было допущено не более двух недочетов.
Отметка «3» ставится, если работа выполнена не полностью:
- в отчете были допущены в общей сложности не более двух ошибок;
- работа выполнена не полностью, однако объем выполненной части таков, что позволяет оценить базовый уровень усвоения знаний.
Отметка «2» ставится в том случае, если:
- работа выполнена не полностью, и объем выполненной части не позволяет оценить уровень усвоения знаний и умений;
- в ходе работы и в отчете обнаружились в совокупности все недостатки, отмеченные в требованиях к оценке«3».
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.