
Периодический закон и Периодическая система химических элементов Д. И. Менделеева.
Периодический закон и Периодическая система химических элементов Д.И. Менделеева — основа современной химии. Они относятся к таким научным закономерностям, которые отражают явления, реально существующие в природе и поэтому никогда не потеряют своего значения.
Периодические закономерности: вертикальную (по группам) и диагональную.
Лучше всего диагональная периодичность свойств неметаллов характеризуется по диагонали В—Si—As—Те—At, которая условно делит элементы на металлы и неметаллы (или диагональ С— Р—Se—I). Две диагонали AI—Le—Sb и Zn—Tn—Pb включают элементы и их соединения с амфотерными свойствами.
Вертикальная периодичность показывает изменения свойств элементов, соединений, образованных ими в группах, главных подгруппах. С ростом порядкового номера усиливающаяся металличность основной характер соединений, ослабевает неметалличность, уменьшается прочность летучих водородных соединений, увеличивается их кислотность.
Если объединить горизонтальную вертикальную и диагональную периодичность, то можно получить «звездную периодичность». Эго позволило Д. И. Менделееву не только предсказать, описать свойства веществ, образованных еще не открытыми химическими элементами, но и указать пути их открытия, природные источники, из которых могли быть получены соответствующие простые вещества.
Однако новые научные открытия стали вступать в противоречие с формулировкой Периодического закона по Д. И. Менделееву: открытие изотопов дало возможность считать химическими элементами виды атомов, характеризующихся одинаковыми зарядами ядра, т.е. содержащих одинаковое число протонов.
Изотопы известны у всех химических элементов. В природе большинство их существует в виде смеси изотопов. Относительная атомная масса элемента равна среднему значению относительной атомной массы всех его природных изотопов с учетом их распространенности.
В Периодической системе под символами химических элементов приведены средние значения их относительных масс.
Следует сделать вывод, что наличие изотопов доказывает, что свойства химических элементов определяются не столько их атомной массой, как предполагал Д. И. Менделеев, сколько зарядом их атомных масс.
Этим и объясняется положение в системе четырех пар элементов, размещенных с нарушением принципа возрастания атомных масс.
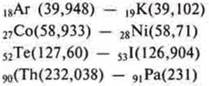
Гениальность Д. И. Менделеева, проявление им научной интуиции состоит в том, он предпочел расположить по сходству в свойствах, тем самым предугадав истинный порядок размещения химических элементов по возрастанию зарядов их атомных ядер, хотя о строении их атомов ничего не знал. Теоретически Ван-де-Брук (Голландия) и экспериментально Г. Мозли (Германия) доказано, что заряд ядра атома соответствует его порядковому номеру.
Таким образом, открытия изотопов и соответствие заряда ядра порядковому номеру химического элемента позволили дать современное определение Периодического закона.
Свойства химических элементов и образуемых ими веществ находятся в периодической зависимости от зарядов их атомных ядер.
Изменение свойств элементов и их соединений в зависимости от положения в Периодической системе.
В чем же причины изменения свойств химических элементов? Каковы причины периодичности? Чтобы ответить на данные вопросы сравним атомы элементов:
а) № 11 - Na, № 15 - Р, № 17 - Сl, № 18 - Аr;
б) № 3, № 19, № 37.
1. Какой заряд ядра данных атомов, что с ним происходит?
Ответ:
а) Na — +11, Р — +15, Cl — +17, Аr — +18; заряд ядра возрастает к концу периода постепенно;
б) Li — +3; К — +19; Rb — +37; заряд ядра возрастает быстро к концу группы, главной подгруппы.
2. Определить количество электронов на внешнем энергетическом уровне. Что наблюдается?
Ответ:
а) Na — 1е-; Р — 5е-; Сl — 1е-; Аr — 8е-. Количество электронов на внешнем энергетическом уровне возрастает постепенно к концу периода.
б) Li — 1е-, К — 1e-, Rb — 1е-. Количество электронов на внешнем энергетическом уровне остается неизменным к концу группы, главной подгруппы.
3. Сколько энергетических уровней в атомах данных элементов, что наблюдается?
Ответ:
а) Na — три, Р — три, Сl — три, Аr — три. Количество энергетических уровней не изменяется, одинаково.
б) Li — два, К — четыре, Rb — пять. Количество энергетических уровней возрастает к концу группы главной подгруппы.
4. Как Вы считаете, что же происходит с атомным радиусов, вследствие данных изменений?
а) к концу периода;
б) к концу группы, главной подгруппы.
Ответ:
а) к концу периода атомный радиус уменьшается вследствие усиленного взаимопритяжения ядра атома и электронов внешнего энергетического уровня (работа с таблицей).
б) к концу группы, главной подгруппы атомный радиус возрастает т. к. увеличивается количество энергетических уровней в атоме.
5. Сказываются ли такие изменения атомных радиусов в периодах и группах, главных подгруппах на способность атомов отдавать электроны, или их присоединениях?
Ответ:
При уменьшении атомного радиуса ослабевает способность атомов отдавать электроны, усиливается способность принимать электроны. К концу периода атомы элементов легче принимают электроны, что обеспечивает проявление неметалличности. При увеличении атомного радиуса возрастает способность атомов отдавать электроны. К концу группы, главной подгруппы атомы элементов легче отдают электроны, что обеспечивает проявление металличности.
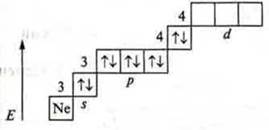
В малых периодах изменение свойств элементов происходит быстро, в больших периодах медленно, т. к. у атомов достраивается превнешний энергетический уровень, а в сверхбольших периодах (VI, VII) изменения происходят еще медленнее, т. к. у лантаноидов и актиноидов достраивается не внешний или предвнешний, а третий снаружи уровень с 18е- до 32е-, вследствие чего свойства этих элементов сходны между собой, и эти элементы образуют семейства лантаноидов и актиноидов.
6. В чем же причина периодичностного изменения свойств элементов? Сравните строение атомов элементов № 3, 11, 19, 37. В чем их сходство и в чем различие?
Ответ:
Это элементы Li, Na, К, Rb. Они расположены в I группе главной подгруппе, имеют одинаковое строение внешнего энергетического уровня Li — 2s', Na — 3s', К — 4s', Rb — 5s'.Однако у каждого из данных элементов электрон внешнего энергетического уровня расположен на разном удалении от ядра атома, вследствие чего химическая активность их разная, но свойства их сходны. Причиной периодичности и является изменение строения внешнего, а также предвнешнего энергетического уровня; повторение числа электронов внешнего (предвнешнего) энергетического уровня.
Составляется краткая схема:
В периодах (к концу периода)

В группах, главных подгруппах (к концу главных подгрупп)

Периодичность изменения свойств элементов сказывается и на свойствах простых веществ, образованных ими и на свойствах более сложных соединений: оксидов и гидроксидов.
В периодах характер химических свойств высших оксидов изменяется от основного до кислотного, причина та же — атомный радиус иона уменьшается. С.О. — возрастает.
III
период 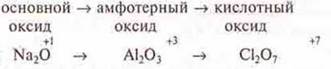
Характер гидроксидов изменяется так же.
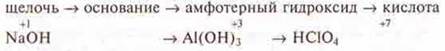
Таким образом, к концу периода в сложных соединениях: оксидах и гидроксидах — наблюдается ослабление основных свойств и усиление кислотных.
Если рассматривать группы, главные подгруппы, где наблюдается усиление металличности к концу группы, то следует сделать вывод, что происходит усиление основного характера оксида, гидроксида, от кислотного, через амфотерный.
Пример: III группа, главная подгруппа.
![]()
Если рассмотреть I группу, главную подгруппу, то наблюдается усиление основного характера, так как это типичные металлы. Гидроксиды, образуемые данными элементами — сильнейшие основания — щелочи.
План характеристики химического элемента по его положению в ПСХЭ Д.И. Менделеева
I. Название элемент, химический знак, относительная атомная масса, порядковый номер; номер периода, номер группы, подгруппы — главная или побочная.
II. Строение атома элемента:
а) заряд ядра атома; количество протонов, нейтронов в ядре атома; количество электронов в атоме;
б) электронная формула атома и электронно-графическое изображение; семейство s-, р-, d-, f-; металлический или неметаллический элемент; С.О. — максимальная, минимальная.
III. Внешний оксид, характер высшего оксида; химические свойства высшего оксида (предложить несколько уравнений реакций.
IV. Гидроксид, характер гидроксида (основания, кислота) химические свойства гидроксида (составить несколько уравнений реакций).
V. Водородное соединение; характер водородного соединения (основной, кислотный).
VI. Дать сравнение данного элемента с рядом стоящими по периоду; по группе, главной подгруппе (сравнивается его металличность или неметалличность).
Примера для закрепления знаний характеристика металлического (Са) и неметаллического (Cl) элементов.
Металлический элемент
I. Кальций (Са); АrСа = 40;
№ 20; IV период; II группа, главная подгруппа.
II. а) +20; 20 протонов: 40 + 20 = 20 нейтронов;
20 электронов;
б) ![]() s-элемент;
s-элемент;
металлический элемент; С.О. +2.
![]()
III. СаО — оксид кальция; основной:
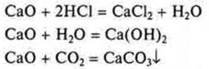
IV. Са(ОН)2 — гидроксид, основание:
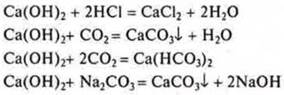
V. ![]() —
гидрид кальция.
—
гидрид кальция.
![]()
VI. Сравниваем Са по периоду с К и Sc; атомный радиус Са больше атомного радиуса Sc, но меньше атомного радиуса К. Поэтому он металличнее Sc, менее металличен, чем К. Сравниваем по группе, главной подгруппе с Mg и Sr; Атомный радиус Са больше атомного радиуса Mg, меньше атомного радиуса Sr, Са металличнее магния, менее металличен, чем Sr.
Неметаллический элемент
I. Хлор (Сl); АrCl = 35,5;
№ 17; III период; VII группа, главная подгруппа.
II. а) +17, 17 протонов; 18 нейтронов; 17 электронов,
б) ![]() р-элемент.
р-элемент.
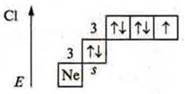
С.О. максимальная: +7; С.О. минимальная: -1.
Сl — неметаллический элемент.
III. Сl2O7 — оксид хлора(VII), кислотный оксид.
![]()
IV. НСlO4 — гидроксид, кислота:
![]()
V. Н+Сl- — водородное соединение, кислотный характер.
VI. По периоду сравниваем с S:
Cl — неметалличнее S, т.к. атомный радиус Cl меньше атомного радиуса S.
По группе главной подгруппе сравниваем с F и Вr.
Сl неметалличнее Вr, т.к. атомный радиус Сl меньше атомного радиуса Вr. По сравнению с F неметалличность Cl меньше, т. к. атомный радиус Сl больше атомного радиуса F.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.