
Температура как мера средней кинетической энергии частиц.
 Мы рассматриваем вещество как
множество молекул, которые движутся. Описывать движение мы научились, в разделе
«Механика» мы разобрали разные модели движения и взаимодействия тел. Можем ли
мы с помощью этих же моделей описать движение молекул? Оказывается, с этим
возникают сложности.
Мы рассматриваем вещество как
множество молекул, которые движутся. Описывать движение мы научились, в разделе
«Механика» мы разобрали разные модели движения и взаимодействия тел. Можем ли
мы с помощью этих же моделей описать движение молекул? Оказывается, с этим
возникают сложности.
Рассмотрим бильярд. Будем считать, что бильярдный стол абсолютно гладкий, так что шар катится по нему не теряя энергии, без трения. Пусть вначале на столе есть один шар, толкнем его. Можно ли проследить его движение? Да, оно прямолинейное, траектория меняется при ударах о борта, и предсказать это тоже можно (см. рис. 9).
 Рис. 9. Движение одного бильярдного
шара
Рис. 9. Движение одного бильярдного
шара
Теперь добавим еще один шар. В промежутках между столкновениями друг с другом каждый шар будет двигаться так, будто он на столе один. А столкновения можно описать законами сохранения импульса и энергии. Да, многое будет зависеть от угла, под которым происходит столкновение, но задача решается, да и сталкиваются они редко. Используя законы динамики, мы можем точно предсказать состояние системы шаров в заданный момент времени (см. рис. 10).
 Рис. 10. Столкновение двух
бильярдных шаров
Рис. 10. Столкновение двух
бильярдных шаров
Пусть у нас на столе много шаров. Можно ли теперь отследить и предсказать движение каждого шара? Можно ли, зная начальное состояние системы, вычислить положение и скорость каждого шара через несколько секунд? Нет, потому что теперь даже малейшее отклонение шара приведет к тому, что он в место столкновения прилетит в немного другой момент и немного под другим углом, и результат может сильно отличаться от предсказанного (см. рис. 11).
Рис. 11. Столкновение нескольких бильярдных шаров
Если разбить одним шаром выстроенный из шаров треугольник, через какое-то время мы не сможем отличить этот стол от стола с изначально хаотично разбросанными шарами. И чем больше шаров и столкновений между ними, тем более непредсказуемым становится движение шаров в системе. Наблюдая за профессиональной игрой в бильярд, вы заметите, что даже сложные комбинации все же редко задействуют больше двух-трех шаров.
Трудно смоделировать систему с
тысячей, миллионом шаров. Что уж говорить про газ, где в одном грамме
порядка ![]() частиц.
Тут нужен другой подход.
частиц.
Тут нужен другой подход.
Оценка задачи о положении всех частиц в веществе
В 1 моль газа содержится ![]() частиц. Если даже не учитывать
столкновений между ними, а только со стенками сосуда, для 1 моль газа нужно
решить минимум
частиц. Если даже не учитывать
столкновений между ними, а только со стенками сосуда, для 1 моль газа нужно
решить минимум ![]() уравнений.
уравнений.
Только для перечисления скорости и
положения каждой частицы, даже без решения уравнений компьютеру с
быстродействием 100 млн операций в секунду потребовалось бы ![]() секунд
или 200 млн лет. Так что задача по факту неразрешима. А главное – эта
информация была бы просто бесполезной: во всем этом хаосе невероятно большого
для нашего воображения количества невидимых глазу частиц, которые движутся с
большими скоростями, нам все равно, с какой скоростью движется каждая из них.
Нам важнее оценить, как ведет себя система в целом.
секунд
или 200 млн лет. Так что задача по факту неразрешима. А главное – эта
информация была бы просто бесполезной: во всем этом хаосе невероятно большого
для нашего воображения количества невидимых глазу частиц, которые движутся с
большими скоростями, нам все равно, с какой скоростью движется каждая из них.
Нам важнее оценить, как ведет себя система в целом.
Любая модель помогает решить конкретно поставленную задачу, сама модель диктуется задачей. Например, если мы строим дорогу, мы используем среднее значение автомобилей, которое будет проезжать по ней, а не траектории и скорости каждого. Если мы строим поликлинику, нам не нужны сведения о состоянии здоровья каждого жителя района, достаточно знать среднюю заболеваемость людей и их количество.
Вернемся к нашему громадному бильярду. Если мы не можем отличить случайное поведение системы от детерминированного, значит, случайная модель – хорошее приближение. Допустим, мы хотим вычислить некое среднее воздействие шаров на стенки стола или количество шаров и их среднюю скорость в некой области. Нам нужны некие средние характеристики и важно, что чем больше объектов, тем труднее решить задачу точно (то есть предсказать поведение каждого шара). Но тем точнее описывают ситуацию усредненные характеристики.
Помогает построить модель именно схожесть движения со случайным. Рассмотрим наши шары все вместе, попробуем дать некие характеристики этой совокупности. Нам не нужны траектории каждого из них, когда их миллиарды. Но мы можем вычислить, например, сколько шаров ударится о стенку в единицу времени. Можем посчитать среднюю среди шаров скорость движения.
Усредненные характеристики – это для нас не ново. Мы наблюдаем за роем пчел и говорим: «Рой был вот здесь и переместился вон туда», не отследив движение каждой пчелы. Даже если в любой момент времени часть пчел летела в противоположную сторону, мы оцениваем некую общую характеристику системы – можем охарактеризовать рой общей подвижностью, «суетливостью». Похоже выглядит толпа людей на массовом мероприятии, мы говорим о ней как о целом: толпа оживилась, успокоилась… Мы употребляем понятие народа, его культуры, хотя вклад каждого человека в культуру всего народа разный, каждый занимается чем-то своим.
Логично и для частиц вещества перейти от набора скоростей к какому-то среднему. На самом деле скорости частиц могут отличаться, у каких-то скорость чуть больше, у каких-то чуть меньше, но среднее значение можно определить.
Скорость движения молекул определяет их кинетическую энергию. Энергия нас интересует потому, что с помощью этого инструмента удобно описывать столкновения частиц. А еще потому, что мы заметили ее связь с тепловыми явлениями. Помните, мы говорили об энергии как о чем-то, что сохраняется: высота или сжатие пружины переходит в скорость, скорость переходит в нагревание. Мы выделили и подробно рассмотрели модель механической энергии и описали, как механическая энергия может превращаться в другие виды энергии, в том числе – мы тогда сформулировали не строго – в как-то связанную с нагреванием.
Чтобы охарактеризовать достаточно
большую совокупность частиц, ввели статистическую величину – температуру. Как для роя пчел или толпы людей
мы пытались придумать «суетливость» и «оживленность», температуру мы определили
строго: она пропорциональна средней кинетической энергии частиц. ![]()
Черта над значением кинетической
энергии означает «среднее», это средняя кинетическая энергия частиц, ![]() –
это масса одного атома или молекулы. Коэффициент пропорциональности
обозначили
–
это масса одного атома или молекулы. Коэффициент пропорциональности
обозначили ![]() :
3/2 – для удобства, немного позже поймем, зачем это было нужно.
:
3/2 – для удобства, немного позже поймем, зачем это было нужно.
Тогда остается ![]() –
это постоянная Больцмана.
–
это постоянная Больцмана.
Температура в этом уравнении абсолютная, по шкале Кельвина. T = t + 2730C
Градусы Цельсия, Кельвина, Фаренгейта
Для измерения физической величины нужен эталон: эталон длины, эталон массы. Или же можно выразить численное значение величины через уже введенные величины. Например, 1 Вт – это работа в 1 Дж, выполненная за 1 секунду.
Исторически понятие температуры возникло намного раньше, чем его связали со средней энергией. Поэтому градусы Цельсия не выражают через единицы энергии, джоули. Для них есть «эталон»: 0 °С – это температура плавления льда; 100 °С – температура кипения воды при нормальном атмосферном давлении. То есть тот факт, что вода замерзает при нуле и кипит при 100 °С, – это не совпадение, так Цельсий составил свою шкалу. Разбив этот интервал на 100 промежуточных делений, получили единицу измерения – один градус Цельсия.
В другой шкале, в градусах Фаренгейта, значения привязаны к другим температурам. Так, ноль в этой шкале соответствует самой низкой температуре в родном городе Фаренгейта, температура плавления льда соответствует 32 °F, а нормальная температура человеческого тела составляет 96 °F. Перевести температуру из градусов Фаренгейта в градусы Цельсия можно по формуле:
![]()
Шкала градусов Цельсия была когда-то введена и к ней привыкли во многих странах. Градусы Фаренгейта привычны для жителей США. А для научных целей используют другую шкалу – шкалу Кельвина. Величина одного градуса у нее такая же, как по шкале Цельсия. Это удобно, изменение температур будет одинаковым в обеих шкалах, а именно изменение температуры нас интересует во многих задачах.
А вот ноль шкал отличается: по шкале Цельсия ноль – это температура замерзания воды, и температура тела может быть ниже нуля. Шкала Кельвина построена следующим образом.
Температура – это мера средней
кинетической энергии молекул.
Понижая температуру, уменьшаем кинетическую энергию молекул. И теоретически,
можно дойти до состояния, когда кинетическая энергия станет равной нулю,
движение частиц прекратится и меньшей температуры достичь уже будет нельзя.
Температура, при этом состоянии и есть ноль градусов по шкале Кельвина. По
шкале Цельсия это ![]() градуса.
То есть шкалы Фаренгейта и Цельсия просто сдвинуты друг относительно друга на
273 градуса:
градуса.
То есть шкалы Фаренгейта и Цельсия просто сдвинуты друг относительно друга на
273 градуса:
![]()
Итак, мы связали кинетическую энергию одной частицы (а значит, и ее скорость), которую мы не можем напрямую измерить, с температурой, которую мы можем и воспринимать своими органами чувств, и измерять с помощью приборов – и это здорово.
Теперь мы можем решить такую задачу: найти скорость теплового движения молекул кислорода при комнатной температуре (20 ˚С). Параметры, характеризующие движение отдельной молекулы, и параметры, характеризующие свойства вещества как целого, условно разделили на микроскопические и макроскопические. К первым относятся масса молекулы, ее скорость, импульс, кинетическая энергия, а ко вторым – масса вещества, объем, давление газа, температура (так как она связана с усреднением по большому количеству частиц). И мы сможем связать микроскопические параметры с макроскопическими.
Решим задачу
Задача. Определите скорость теплового движения молекул кислорода при температуре 20 ˚С.
Анализ условия. В задаче описан газ и идет речь о температуре и скорости движения его молекул. Мы связали температуру со средней кинетической энергией молекул (а значит, и скоростью), так что будем использовать эту связь. Там фигурирует средний квадрат скорости, и, если мы извлечем из него корень, получим среднюю квадратичную скорость молекул – ее и подразумевают под скоростью теплового движения.
Физическая часть решения задачи. Мы ввели температуру как величину, пропорциональную средней кинетической энергии частиц:
![]()
В этом уравнении неизвестна масса
одной молекулы кислорода. Мы точно знаем массу 1 моль частиц – это молярная
масса, для кислорода это ![]() .
И мы знаем, что в 1 моль –
.
И мы знаем, что в 1 моль – ![]() молекул.
Значит, масса одной молекулы равна:
молекул.
Значит, масса одной молекулы равна:
![]()
Получили систему из двух уравнений, из которой осталось выразить скорость.
Сделаем это в математической части решения. Подставим массу одной молекулы из второго уравнения в первое:
![]()
Выразим среднюю квадратичную скорость:
![]()
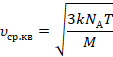
Решение готово, но добавим еще одну
деталь. Произведение двух констант ![]() встречается
в уравнениях очень часто, потому его решили посчитать один раз, обозначить
одной буквой
встречается
в уравнениях очень часто, потому его решили посчитать один раз, обозначить
одной буквой ![]() и
потом использовать готовое значение:
и
потом использовать готовое значение:
![]()
Эту величину назвали универсальной газовой постоянной. Тогда вычислений останется меньше:
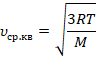
Вычислим, переведя температуру в СИ: к 20 ˚С, чтобы перевести в кельвины, нужно прибавить 273:
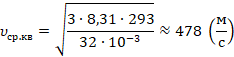
Как видим, молекулы движутся с большими для привычного нам мира скоростями, это больше скорости звука в воздухе.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.