
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ
Государственное образовательное учреждение
Высшего профессионального образования
«Бирская государственная
социально-педагогическая академия»
факультет биологии и химии
кафедра химии и методики обучения химии
Лыгин Сергей Александрович
Валиев Роберт Данисович
Учебно-методическое пособие
Мониторинг естественных и искусственных
водоёмов села Сейтяково Балтачевского района республики Башкортостан
БИРСК 2010
Содержание
Введение ……………………………………………………………..……………3
Глава I.ЭКОЛОГИЧЕСКИЙ МОНИТОРИНГ ПИТЬЕВОЙ ВОДЫ…...………7
1.1. Физико- географическое положение Балтачевского района……...……..7
1.2. Роль воды в жизни человека…………………………………………..…..8
1.3. Загрязнение воды.………………………………………………………………..…10
1.4. Экологический мониторинг воды.....…………………………………………..14
1.4.1. Биоиндикация ……………….…………………………….………………16
1.4.2. Требования к качеству питьевой воды Всемирной организацией здравоохранения ……………………………………………………...........…..18
1.4.3. Национальные первичные нормативы питьевой воды…………………23
1.5. Тяжелые металлы …………………………………………………………26
1.5.1. Токсичность тяжелых металлов в организме человека и живых организмов……………………….……………………………………....................28
1.5.2. Предельно допустимая концентрация химических веществ в воде …..30
1.5.3. Влияние тяжелых металлов на организм человека……………………..32
Глава II.ЭКСПЕРЕМЕНТАЛЬНАЯ МЕТОДИЧЕСКАЯ РАБОТА…………...34
2.1. Методика выполнения измерений массовой концентрации свинца и меди в воде села Сейтяково Балтачевского района республики Башкортостан…...34
2.2. Подготовка посуды…………………………………………………………..…...36
2.3. Приготовление растворов………………………………………..………….36
2.4. Приготовление фонового электролита………………………………..…………37
2.5. Подготовка проб к анализу…………………………………..……………..38
2.6. Порядок измерений………………………………………………..……………..38
2.7. Обсуждение протоколов измерений………………………………..…………...39
Заключение…………………………………………………………………….…47
Литература……………………………………………………………………….48
Приложение………………………………………………………………………50
Введение
Вода занимает особое положение среди природных богатств Земли. Известный русский и советский геолог академик А. П. Карпинский говорил, что нет более драгоценного ископаемого, чем вода, без которой жизнь невозможна. Существование всех форм жизни на земле связано с потреблением воды. Поэтому загрязнение водоемов, поверхностных и подземных водных источников несет в себе угрозу существованию живой природы и ее высшей формы – человека [1].
Поверхностные воды в основном сосредоточены в Мировом океане,
содержащем около 91% всей воды на Земле. Поверхность океана (акватория) составляет 361 млн. км2. Она примерно в 2,4 раза больше площади суши –
территории, занимающей 149 млн. км2. Если распределить воду ровным слоем, то она покроет Землю толщиной 3000 м.
Вода в океане (94%) и под землей – соленая. Количество пресной воды
составляет 6% от общего объема воды на Земле, причем очень малая ее доля
(всего 0,36%) имеется в легкодоступных для добычи местах. Большая часть
пресной воды содержится в снегах, пресноводных айсбергах и ледниках (1,7%),находящихся в основном в районах южного полярного круга, а также глубоко под землей (4%). Годовой мировой речной сток пресной воды составляет 37,3-47 тыс. км3. Кроме того, может использоваться часть подземных вод, равная 13 тыс. км3 [2].
В настоящее время человечество использует 3,8 тыс. км3. воды ежегод-но, причем можно увеличить потребление максимум до 12 тыс. км3. При ны-нешних темпах роста потребления воды этого хватит на ближайшие 25-30 лет.
Выкачивание грунтовых вод приводит к оседанию почвы и зданий и понижению уровней подземных вод на десятки метров. Огромное значение вода имеет в промышленном и сельскохозяйственном производстве. Общеиз-вестна необходимость ее для бытовых потребностей человека, всех растений и животных. Для многих живых существ она служит средой обитания.
Рост городов, бурное развитие промышленности, интенсификация сельского хозяйства, значительное расширение площадей орошаемых земель, улучшение культурно-бытовых условий и ряд других факторов все больше усложняет проблемы обеспечения водой.
В то же время 60% суши не имеет достаточного количества пресной воды. Четверть человечества (примерно 1,5 млн. человек) ощущает ее недостаток, а еще500 млн. страдают от недостатка и плохого качества питьевой воды, что приводит к кишечным заболеваниям.
Значительное количество воды расходуется для потребностей отрасли животноводства, а также на бытовые потребности населения. Большая часть воды после ее использования для хозяйственно-бытовых нужд возвращается в реки в виде сточных вод.
Дефицит пресной воды уже сейчас становится мировой проблемой. Все более возрастающие потребности промышленности и сельского хозяйства в воде заставляют все страны, ученых мира искать разнообразные средства для решения этой проблемы.
На современном этапе определяются такие направления рационального
использования водных ресурсов: более полное использование и расширенное
воспроизводство ресурсов пресных вод; разработка новых технологических
процессов, позволяющих предотвратить загрязнение водоемов, и свести к минимуму потребление свежей воды.
Актуальность выбранной темы определяется тем, что в настоящее время, проблема загрязнения водных объектов (рек, озер, морей, грунтовых вод и т.д.) является наиболее значимой, т.к. всем известно выражение - «вода - это жизнь». Без воды человек не может прожить более трех суток, но, даже понимая всю важность роли воды в его жизни, он все равно продолжает жестко эксплуатировать водные объекты, безвозвратно изменяя их естественный режим сбросами и отходами.
Вода составляет большую часть любых организмов, как растительных, так и животных, в частности, у человека на её долю приходится 60-80% массы тела.
Вода является средой обитания многих организмов, определяет климат и изменение погоды, способствует очищению атмосферы от вредных веществ, растворяет, выщелачивает горные породы и минералы и транспортирует их из одних мест в другие и т.д. Для человека вода имеет важное производственное значение: она и транспортный путь, и источник энергии, и сырье для получения продукции, и охладитель двигателей, и очиститель и т.д.
Сегодня воды, пригодной для питья, промышленного производства и орошения, не хватает во многих районах мира. Нельзя не обращать внимания на эту проблему, т.к. на следующих поколениях скажутся все последствия антропогенного загрязнения воды. Вследствие проживания в опасно отрав-ленной среде обитания распространяются раковые и другие экологически зависимые заболевания различных органов. У половины новорожденных получивших даже незначительное дополнительное облучение на определенном этапе формирования плода в теле матери, обнаруживаются задержки умственного развития. Следовательно, эту проблему надо решать как можно скорее и радикально пересмотреть проблему очищения промышленных сбросов.
Предмет исследования: количественное содержание свинца и меди в водоемах с.Сейтяково Балтачевского района.
Гипотеза: содержание тяжелых металлов в образцах воды, взятых из водоемов с.Сейтяково Балтачевского района различно и незначительно пре-вышает нормы ПДК.
Цель: определение количественного содержания тяжелых металлов в воде исследуемого объекта и выявление степени её загрязнения.
Достижение поставленной цели требовало решения ряда задач:
- выявление роли воды в жизни человека;
- определение основных источников загрязнения воды;
- выявление особенностей и опасности химических загрязнений воды (в частности тяжелыми металлами);
- проведение необходимых практических исследований состояния водоемов (определение содержания меди и свинца);
- обработка результатов практического этапа исследования.
Методы и приемы исследования:
- изучение специальной литературы;
-отбор проб позволил собрать образцы воды для химического анализа;
-освоение методик определения количественного содержания анализируемых показателей в пробах с разных водоемов (р.Танып, р.Кигазы и колодец с. Сейтяково).
ГЛАВА I. Экологический мониторинг питьевой воды
1.1. Физико- географическое положение Балтачевского района
Балтачевский район (рис.1) образован в 1930 году. Число сельских администраций - 17, населенных пунктов - 81. Районный центр - с. Старо-балтачево, находится в 220 км от столицы республики г. Уфы. Территория района - 1598 кв. км. Через район проходит автомагистраль Чураево-Старобалтачево-Верхние Татышлы. На 01.01.1998 года население района составило 26444 человека,а по состоянию 01.01.2010 года численность населения с.Сейтяково составляет – 1275 чел.
Сельское поселение Сейтяковский сельсовет граничит с сельскими по-селениями: Тучубаевский сельсовет, Старобалтачевский сельсовет, Норкин-ский сельсовет и муниципальным районом Бураевский район.
Администрация сельского поселения расположена в селе Сейтяково, от районного центра 15 км, к юго-западу вдоль реки Быстрый Танып. На терри-тории сельского поселения Сейтяковский сельсовет расположено пять дере-вень: село Сейтяково, деревня Стародюртюкеево, деревня Новодюртюкеево, деревня Староямурзино, деревня Чурапаново.
Балтачевский район расположен в северной части лесостепной зоны. По характеру поверхности представляет волнисто-увалистую равнину, пере-сеченную долинами рек, склонами и холмами. Максимальная отметка водо-раздела - 373 м абсолютной высоты. Климат умеренно континентальный. Среднегодовая температура воздуха - 2,6°С. Часты поздние весенние и ран-ние осенние заморозки. Продолжительность вегетационного периода состав-ляет 169 дней. Преобладают ветры южного и юго-западного направлений. Основные типы почв - серые лесные и оподзоленные черноземы, по долине реки Быстрый Танып - пойменные. Район обладает хорошо развитой речной сетью. Главная водная артерия - многоводная, с перекатами река Быстрый Танып, ее левый приток - река Ар, правые - реки Тошкур, Раскала. Ширина поймы реки Быстрый Танып - 1-1,5 км [3].
Рис.1. Карта Балтачевского района
1.2. Роль воды в жизни человека
«Нельзя сказать, что вода необходима для жизни: она и есть жизнь»,- так сказал Сент-Экзюпери об этой жидкости, которую мы употребляем, не особенно задумываясь. Вода представляет собой наиболее ценный для чело-века продукт, и наш организм на 60-70% состоит из воды (для эмбриона на пятом месяце - на 94%). Вода доставляет в клетки организма питательные вещества (витамины, минеральные соли и др.) и уносит отходы жизнедея-тельности. Необходимо пить, как минимум, 1,5 литра воды в день, чтобы обеспечить организму достаточную термическую стабильность и не терять более 15% содержащейся в нем воды, иначе организму грозит обезвожива-ние.
Парадоксальный факт: вода необходима для жизни, но она же является и одной из главных причин заболеваемости в мире. Опасность может быть микробиологической: вода в природе содержит множество микроорганизмов, вызывающих у человека заболевания (холера, тиф, гепатит, гастроэнтерит и др.). Загрязнение может быть и химическим, с немедленными или отсрочен-ными последствиями. Вода должна быть не только очищена от этого загряз-нения, но и быть приятной на вкус [4].
Вода имеет очень большое значение в жизни растений, животных и че-ловека. Происхождение жизни на Земле обязано воде. В организме вода представляет собой среду, в которой протекают химические процессы, обес-печивающие жизнедеятельность организма; кроме того, вода принимает уча-стие в целом ряде биохимических реакций как растворитель.
Вода очень необычная по своим физико-химическим свойствам субс-танция. Плотность воды (при нормальных условиях равна 1,0 г/см3) при переходе ее из твердого состояния в жидкое не уменьшается, как у других веществ, а возрастает. При нагревании воды от 0 до 4°С плотность ее также увеличивается. При 4°С вода имеет максимальную плотность, при даль-нейшем нагревании ее плотность уменьшается. Это свойство воды очень ценно для жизни. Если бы при понижении температуры и при переходе из жидкого состояния в твердое плотность воды изменялась, как это происходит у подавляющего большинства веществ, то при приближении зимы поверх-ностные слои природных вод охлаждались бы до 0°С и опускались на дно, освобождая место более теплым слоям, и так могло продолжаться до тех пор, пока вся масса воды не приобретет температуру 0°С, в этом случае вода промерзает, на всю глубину водоема. Многие формы жизни в воде были бы невозможны. Но так как наибольшей плотность вода достигает при 4 °С, то перемещение ее слоев, вызываемое охлаждением, заканчивается при дос-тижении этой температуры. При дальнейшем понижении температуры охла-жденный слой, обладающий меньшей плотностью, остается на поверхности, замерзает и тем самым защищает лежащие ниже слои от дальнейшего охлаж-дения и замерзания.
Большое значение имеет тот факт, что вода обладает аномально высо-кой теплоемкостью 4,18 Дж/(г К). Поэтому в ночное время, а также при пе-реходе от лета к зиме вода остывает медленно, а днем или при переходе от зимы к лету так же медленно нагревается, являясь, таким образом, регулято-ром температуры на земном шаре [5].
1.3. Загрязнение воды
Загрязнение воды - это попадание в нее элементов, делающих ее непри-годной для употребления человеком. Это может произойти на всех этапах круговорота воды (даже в атмосфере, где вода содержится в виде облаков). Происхождение загрязнения может быть коммунальное (канализация), про-мышленное, сельскохозяйственное и, даже, природное.
Промышленное развитие привело к очень сильному химическому за-грязнению речных вод. Открытие бактериальной природы холеры, брюшного тифа, дизентерии, гепатита и других кишечных инфекций привело в конеч-ном итоге к прекращению забора воды для водопроводов в естественных во-доемах. В Европе стали создаваться водохранилища, наполнявшиеся талой и грунтовой водой и водоохранные зоны. Появились большие установки для стерилизации воды хлором и ее фильтрации. Но вместе с этим стала интен-сивно развиваться коммерческая продажа чистой и минеральной воды из раз-нообразных источников - родников.
Существует шесть классов качества воды. Эта система оценки качества вод принята в зарубежных странах и положена в основу ГОСТ 17.12.04.77 и ГОСТ 17.13.07.82.
1 класс: экологически полноценная вода, может использоваться для питья, рекреации, рыбоводства и орошения;
2 класс: экологически полноценная вода, имеет питьевое значение, может использоваться для рекреации, рыбоводства и орошения;
3 класс: экологически полноценная вода, может использоваться для питья с предварительной очисткой, а также рыбоводства и орошения;
4 класс: экологически неблагополучная вода, имеет ограниченное применение в рыбоводстве и орошении, пригодна для технических целей;
5 класс: экологически неблагополучная вода, имеет техническое значе-ние;
6 класс: экологически неблагополучная вода, применяется для техни-ческих целей с предварительной очисткой [17].
Загрязненные природные воды ухудшают экологическую ситуацию в биогеоценозе, ведут к гибели существующих природных форм, ставят под сомнение возможность выживания различных форм высших организмов, в том числе и человека. В условиях повсеместного загрязнения окружающей среды, в том числе ухудшения качества природных вод, одной из актуальней-ших проблем выживания человечества становится проблема обеспечения лю-дей питьевой водой высокого качества.
В большинстве случаев загрязнение пресных вод остаётся невидимым, поскольку загрязнители растворены в воде. Но есть и исключения:
- пенящиеся моющие средства;
- плавающие на поверхности нефтепродукты;
- попадающие в воду неочищенные стоки.
Есть несколько природных загрязнителей. Находящиеся в земле соединения алюминия попадают в систему пресных водоёмов в результате химических реакций. Паводки вымывают из почвы лугов соединения магния, которые наносят огромный ущерб рыбным запасам. Однако объём естественных загрязняющих веществ ничтожен по сравнению с произ-водимыми человеком. Фермеры используют различные химикаты, попадаю-щие в конечном итоге в пресную воду:
- гербициды;
- инсектициды;
- акарициды;
- фунгициды и дезинфицирующий раствор для овец, содержащие в целом 450 активных ингредиентов — биоцидов [11].
В землю вносятся стимулирующие рост растений фосфаты и нитраты, а силосные бурты, свиноводческие фермы и птицефермы являются источником большого количества ядовитых стоков. Помимо дезинфицирующих средств пресную воду заражают и фармацевтические препараты (антибиотики, гормоны и ингибиторы роста). Для дезинфи-цирования питьевой воды используются химические реагенты, следы кото-рых остаются в воде. Считающийся канцерогенным тригалометан — побоч-ный продукт хлорирования воды. В 1988 году в прессе широко освещалось применение сульфата алюминия при очистке воды: тогда несколько тонн это-го вещества были сброшены в систему водоснабжения одного английского городка и вызвали массовое заболевание среди местных жителей. Ежегодно в водные бассейны попадают тысячи химических веществ с непредсказуемым действием, многие из которых представляют собой новые химические соеди-нения. В воде могут быть обнаружены повышенные концентрации токсич-ных тяжелых металлов (как кадмия, ртути, свинца, хрома), пестициды, нитра-ты и фосфаты, нефтепродукты, поверхностно-активные вещества (ПАВы). Как известно, ежегодно в моря и океаны попадает до 12 млн тонн нефти. Оп-ределенный вклад в повышение концентрации тяжелых металлов в воде вно-сят и кислотные дожди. Они способны растворять в грунте минералы, что приводит к увеличению содержания в воде ионов тяжелых металлов. С атом-ных электростанций в круговорот воды в природе попадают радиоактивные отходы. Сброс неочищенных сточных вод в водные источники приводит к микробиологическим загрязнениям воды. По оценкам Всемирной организа-ции здравоохранения (ВОЗ) 80 % заболеваний в мире вызваны неподобаю-щим качеством и антисанитарным состоянием воды. В сельской местности проблема качества воды стоит особенно остро — около 90 % всех сельских жителей в мире постоянно пользуются для питья и купания загрязненной во-дой.
К самым явным признакам загрязнения пресных водоёмов относится цветение воды (бурное развитие фитопланктона). Этот процесс наблюдается, когда вода обогащается смесью органических соединений, выщелоченных из окружающей почвы. Такое обогащение (эвтрофикацию) в большей степени вызывают фосфаты, чем нитраты.Водоросли на поверхности воды действуют как густой лесной полог, не пропуская солнечный свет. Это губительно ска-зывается на производящих кислород водорослях, от которых зависит жизнь водных беспозвоночных и позвоночных. К тому же определённые виды сине-зелёных водорослей выделяют ядовитые вещества, поражающие рыб и дру-гие водные организмы. В результате многие виды отдыха на воде в летние месяцы запрещены в связи с разрастанием и токсичностью водорослей. При-чиной цветения последних в озёрах и водоёмах может также быть вырубка лесов и удобрение лесной почвы — в обоих случаях в воду попадают пита-тельные вещества.Как правило, загрязнение водоёмов приводит к гибели жи-вой природы, в первую очередь рыб. Но возможна быстрая повторная коло-низация и восстановление популяций, особенно с помощью человека. Неко-торые беспозвоночные переселяются на поражённые участки из находящихся выше по течению мест; другие перелетают сюда за считанные часы. Одни ор-ганизмы (такие как речные блюдечки, чьи жабры забиваются илом) чувстви-тельны к нарушению экологического баланса, а другим видам (включая по-дёнок) нипочём довольно высокие уровни загрязнения. Трубчатые черви пог-лощают бактерии и личинок разных видов звонцов, а пиявки (среди них He-lobdella stagnalis) легко переносят эвтрофикацию и низкое содержание кисло-рода [13].
Эксперты (ВОЗ) установили, что очень многих болезней и смертей можно было бы избежать благодаря единственному недорогому средству – обеспечению населения чистой питьевой водой [14].
Какую же питьевую воду можно назвать биологически (физиологичес-ки) полноценной? Очевидно, что, с одной стороны, концентрация химичес-ких компонентов такой воды не должна превышать предельно-допустимых норм (ПДК). С другой стороны, для ряда химических соединений есть и нижний порог безопасности. Постоянное употребление воды с дефицитом кальция, магния, углекислоты, йода, фтора также неблагоприятно влияет на организм и влечёт развитие различных болезней. Например, дефицит фтора ведёт к развитию кариеса, а недостаток йода способствует возникновению заболеваний щитовидной железы.
Законы — действенное средство предотвращения загрязнения, но до-биться их соблюдения трудно. Поэтому новая международная инициатива — «платит сторона, виновная в загрязнении» — идеальна по сути, но редко даёт плоды. ВОЗ опубликовала рекомендации по допустимым уровням загрязнения. Например, содержание кадмия в воде не должно превышать 3*10-3 мг/л.
Англия, вероятно, первой в мире приняла закон о загрязнении рек, по-скольку ещё в 1197 г. король Ричард I Львиное Сердце подписал первую хар-тию о Темзе.
Сегодня Европейское Сообщество издаёт директивы о качестве воды, но правительства европейских стран не спешат выполнять эти требования.
Так, в 1992 г. 9 из 12 стран — членов ЕС превысили уровень содержания нитратов в своих водоёмах. По новому законодательству, от всех членов ЕС требовалось к 2002 г. создать специальные очистные станции для обработки воды для городского и промышленного потребления, чтобы предотвратить загрязнение рек. В большинстве стран эта работа выполнена [14].
1.4. Экологический мониторинг воды
Мониторинг (от английского monitor – предупреждающий) – система контроля (наблюдение, оценка, прогноз) за состоянием какого-либо объекта или явления. Составной частью экологического мониторинга, причём наибо-лее развитой в настоящее время, является контроль за загрязнением водной и воздушной сред (накоплением в окружающей среде тяжёлых металлов, пес-тицидов и других ксенобиотиков, содержанием основных загрязняющих ком-понентов атмосферы и т.д.) [6].
Цель мониторинга – определение степени воздействия человека на природу и прогнозирование экологической ситуации [8].
При ведении мониторинга воды выявляются следующие процессы:
- эволюционные (связанные с естественноисторическими процессами развития);
- цикличные (связанные с суточными, сезонными, годовыми и иными периодами изменений природного характера);
- антропогенные (связанные с человеческой деятельностью);
- чрезвычайные ситуации (связанные с авариями, катастрофами, сти-хийными и экологическими бедствиями).
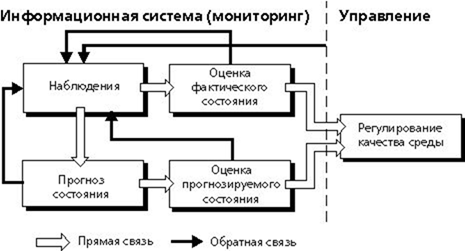
Рис.2. Блок-схема системы мониторинга
Система экологического мониторинга должна накапливать, системати-зировать и анализировать информацию:
- о состоянии окружающей среды;
- о причинах наблюдаемых и вероятных изменений состояния (т.e., об источниках и факторах воздействия);
- о допустимости изменений и нагрузок на среду в целом; о сущес-твующих резервах биосферы.
Таким образом, в систему экологического мониторинга входят наблю-дения за состоянием элементов биосферы и наблюдения за источниками и факторами антропогенного воздействия [9].
Государственный доклад “О состоянии окружающей природной среды в РФ в 1995 г. определяет экологический мониторинг в РФ как комплекс вы-полняемых по научно обоснованным программам наблюдений, оценок, прог-нозов и разрабатываемых на их основе рекомендаций и вариантов управлен-ческих решений, необходимых и достаточных для обеспечения управления состоянием окружающей природной среды и экологической безопасностью [7].
В соответствии с приведенными определениями и возложенными на систему функциями мониторинг включает три основных направления дея-тельности (рис.2):
-наблюдения за факторами воздействия и состоянием среды;
-оценку фактического состояния среды;
-прогноз состояния окружающей природной среды и оценку прогнози-руемого состояния.
Основными задачами мониторинга источников антропогенного воздей-ствия на водные объекты являются:
-оценка качественного и количественного состава сбрасываемых сточ-ных вод непосредственно в месте выпуска в водные объекты;
-оценка воздействия на водный объект, связанная непосредственно с источником антропогенного воздействия (примерно в 500м выше и ниже по течению от источника.
Таким образом, в систему экологического мониторинга входят наблю-дения за состоянием элементов биосферы и наблюдения за источниками и факторами антропогенного воздействия.
Мониторинг загрязнения водных объектов и почв осуществляется в стационарных и передвижных лабораториях. Загрязнения воды и почвы контролируются также биологическими и радиометрическими методами. На основании результатов мониторинга разрабатываются рекомендации по снижению уровня загрязнения окружающей среды и прогноз на будущее [10].
1.4.1. Биоиндикация
Под биоиндикацией следует понимать комплекс специфических реакций живого организма – биоиндикатора (или какого-либо биологического элемента – группы клеток, ткани, органа) на воздействие определённого вещества, причём эти реакции можно регистрировать и по ним давать оценку присутствия загрязнителя и его концентрации. Некоторые биоиндикаторы способны давать точную интегральную картину действия какого-либо химического фактора на окружающую среду в показателях, имеющих биологический смысл. Для определения ряда токсикантов и загрязнителей в сточных водах с помощью микробов можно также воспользоваться описанным ранее явлением накопления. Так, биотехнологическим путём были получены штампы бактерий, концентрирующие в своих клетках ртуть. Таким образом, используя этот штамп, можно достичь двух результатов:
-во-первых, наличие ртути в стоках может быть надёжно иденти-фицировано вследствие её накопления в клетках бактерий (повышается надёжность анализа);
-во-вторых, сточные воды затем могут быть очищены от токсиканта (используя фильтры, улавливающие этих бактерий).
Одной из самых распространённых систем контроля над загряз-нителями, где использовались бы живые организмы, является метод определения биохимической потребности в кислороде (БПК). По этому методу фиксируется метаболическая активность микроорганизмов, которые окисляют питательные вещества, содержащиеся в пробе воды. Чем больше пищи для микробов (т.е. чем больше загрязнены стоки), тем интенсивнее и в больших количествах потребляется ими кислород .
Именно для быстрого определения БПК сточных вод были разработаны одни из первых биосекторов. Биосектором называют анализирующее устройство, главной частью которого может стать чувствительный электрод, содержащий между полупроницаемыми мембранами ферменты или микроорганизмы.
Задача последних – отреагировать на появление в зоне электрода загрязнителя, причём реакция эта, как правило, специфична – ферменты, группа клеток или микробы узнают только «комплементарный» или химический агент. Первыми в биосекторах были использованы индивидуальные ферменты – катализаторы биохимических реакций. Дело в том, что ферменты характеризуются высокой стереоспецифичностью взаимодействия с молекулами, с которыми им предстоит работать (принцип «ключа и замка») (рис. 3). Фермент образует рабочий комплекс лишь с той молекулой – субстратом, которая пространственно подходит к его активному центру, как ключ к замку
Кроме того, реакции, которые осуществляют биокатализаторы, протекают с большими скоростями и поэтому ферменты в биосекторах позволяют делать анализ практически мгновенно, что является очень ценной характеристикой экологического контроля [12].
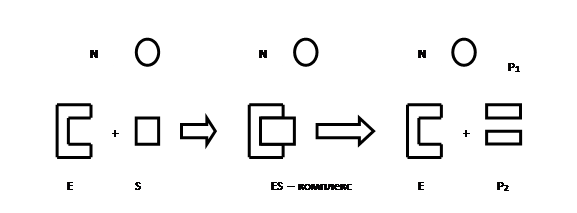
Рис. 3. Схема взаимодействия фермента с превращаемой молекулой-субстратом (принцип «ключа и замка»): Е – фермент; S – субстрат соответствующий, N – несоответствующий; Р1, Р2 – продукты реакции.
1.4.2. Требования к качеству питьевой воды ВОЗ
В современном мире качество воды регулируется стандартами ВОЗ, стандартами отдельных государств. Все они выполняют лишь одну функцию: представлять населению воду, безопасную для здоровья. Поэтому при подборе оборудования для очистки воды рекомендуется ориентироваться на достижение высшего качества воды.
Основными международными документами, рекомендации или требования которых принимаются в качестве базовых при разработке национальных документов в большинстве стран мира, являются «Руководство по контролю качества питьевой воды», разработанное Всемирной организацией здравоохранения (Руководство ВОЗ) и Директива по питьевой воде Европейского Сообщества (Директива ЕС). Кроме того, ряд стран использует в качестве базовых требований нормативы Агентства по охране окружающей среды США (U.S/ Environmental Protection Agency-EPA) [14].
Параметры качества питьевой воды разбиты на несколько групп: органолептические показатели;физико-химические параметры; вещества, присутствие которых в воде в больших количествах нежелательно; токсичные вещества, микробиологические показатели и параметры умягченной воды, предназначенной для потребления. Общая тенденция развития системы нормативных требований к качеству питьевой воды характеризуется ростом числа ее контролируемых показателей. Евросоюз нормирует 66 показателей по питьевой воде - это самые жесткие требования. ВОЗ рекомендует 54. Главный принцип нормирования, который лежит в основе разработки предельно допустимых концентраций или рекомендаций ВОЗ, - влияние какого-либо вещества на здоровье человека.В Евросоюзе в нормативах на питьевую воду учитывается не только безопасность для здоровья, но и высокие вкусовые качества. Концентрация вредного вещества в воде не должна оказывать прямого или косвенного влияния на организм человека в течение всей его жизни и на здоровье последующих поколений, и не должна ухудшать гигиенические условия водопользования. Директива Европейского Сообщества (European Community, EC), касающаяся "качества воды, предназначенной для потребления населением" (80/778/EC) была принята Европейским Советом 15 июля 1980 года. Более известный под названием "Директива по Питьевой Воде" (Drinking Water Directive), данный документ лег в основу водного законодательства европейских стран-членов ЕС. Однако, 3 ноября 1998 г. Советом Европейского Союза взамен действовавшей с 1980 г была принята новая директива "По качеству питьевой воды, предназначенной для потребления человеком" 98/83/EC. В новой директиве перечень обязательных для контроля параметров сокращен, но предельные значения по многим из них ужесточены [15].
Питьевая вода – это вода, пригодная к употреблению человеком и отвечающая критериям качества, то есть, - вода безопасная и приятная на вкус. В масштабах мирового сообщества критерии качества были утверждены Европейским сообществом и приняты каждой из стран. В России действует ГОСТ «Вода питьевая» [14].
Санитарные Правила и Нормы 2.1.4.559-96 «Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества», утверждены постановлением Госкомсанэпиднадзора РФ от 24.10.1996 г. и введенны в действие с 1 июля 1997 года.
СанПиН устанавливают гигиенические требования к питьевой воде, нормирует содержание вредных химических веществ, наиболее часто встречающихся в природных водах, а также поступающих в источники водоснабжения в результате хозяйственной деятельности человека, определяет органолептические и некоторые физико-химические параметры питьевой воды. По большинству параметров российский СанПиН удовлетворяет рекомендациям ВОЗ и не уступает зарубежным стандартам. Качество воды характеризуют следующие параметры:
-общие физико-химические показатели качества воды;
-орагнолептические показатели;
-бактериологические и паразитологические показатели;
-радиологические показатели;
-показатели неорганических и органических примесей, а также ряд других параметров, часто употребляемых в водоподготовке.
Требования нового Руководства ВОЗ приведены в таблице 1 [16].
Таблица 1
Нормативы воз для питьевой воды по неорганическим компонентам
|
Компонент |
Норматив, мг/л |
Примечание |
|
||
|
Токсикологические показатели |
|
||||
|
Барий |
0.7 |
|
|
||
|
Бериллий |
- |
Нет надежных данных для установления норматива |
|
||
|
Бор |
0.5 |
|
|
||
|
Кадмий |
0.003 |
|
|
||
|
Марганец |
0.5 |
Меньшие концентрации обнаруживаются органолептически |
|
||
|
Медь |
2 |
|
|
||
|
Молибден |
0.07 |
|
|
||
|
Мышьяк |
0.01 |
|
|
||
|
Никель |
0.02 |
|
|
||
|
|
|
|
|
||
|
Нитраты |
50 |
|
|
||
|
Нитриты |
3 |
|
|
||
|
Ртуть общая |
0.001 |
|
|
||
|
Свинец |
0.01 |
Данный норматив в некоторых системах водоснабжения может не выполняться, тогда в них следует принимать все меры для снижения степени риска |
|
||
|
Селен |
0.01 |
|
|
||
|
Сурьма |
0.005 |
|
|
||
|
Уран |
0.002 |
|
|
||
|
Фтор |
1.5 |
|
|
||
|
Хром |
0.05 |
|
|
||
|
Цианид |
0.07 |
В национальных стандартах следует учитывать местные особенности и объем потребляемой воды |
|
||
|
Органолептические показатели |
|
||||
|
Алюминий |
0.2 |
Вызывает осадок (взвесь), изменение цвета |
|
||
|
Аммоний |
1.5 (1.5) |
Запах и привкус |
|
||
|
Железо |
0.3 (0.3) |
Вызывает окрашивание белья и посуды |
|
||
|
Жесткость |
При низкой жесткости повышается коррозивность воды. При высокой образуется накипь (7 мг*экв/л) |
|
|
||
|
Марганец |
0.1 |
Вызывает окрашивание белья и посуды |
|
||
|
Медь |
1 |
Привкус, вызывает окрашивание белья и посуды |
|
||
|
Натрий |
200 |
Привкус |
|
||
|
Сероводород |
0.05 |
Запах и привкус |
|
||
|
Сульфаты |
250 (500) |
Привкус |
|
||
|
Хлориды |
250 (350) |
Привкус, вызывает коррозию |
|
||
|
Цинк |
3 |
Цвет, привкус |
|
||
|
Другие органолептические показатели |
|
||||
|
Мутность |
5 |
Внешний вид. При эффективном конечном обеззараживании <1 |
|
||
|
Привкус и запах |
(2 балла) |
Вода должна быть приятной |
|
||
|
Температура |
|
Вода должна иметь оптимальную температуру |
|
||
|
Цвет |
15 стандартных единиц цвета (20) |
Внешний вид |
|
||
|
pH |
6.5 – 8.5 ед. pH (6.0 – 9.0) |
Низкий pH увеличивает коррозивность. Высокий pH вызывает привкус, мыльный вкус. |
|
||
|
Вещества не оказывающие влияния на здоровье при обычно встречающихся концентрациях в воде |
|
||||
|
Асбест |
Глифосат |
Олово |
|
||
|
Серебро |
0,05 |
|
|
||
Проблема чистоты воды - это государственная проблема. О чем свидетельствует информация фактически более чем полуторагодовой давности, приведенная ниже, но не потерявшая своей актуальности и сегодня - о состоявшемся заседании Межведомственной Комиссии Совета Безопасности РФ по экологической безопасности. Но на сегодняшний день ситуация с очисткой воды практически не изменилась. Таким образом, можно констатировать тот факт, что у разработчиков и производителей оборудования для очистки воды на всех уровнях только прибавится работы при наличии финансирования и действительно государственного подхода к воде [17].
1.4.3. Национальные первичные нормативы питьевой воды
Национальные первичные нормативы питьевой воды (NPDWR или первичные стандарты) являются обязательными для общественных водопроводных сетей. Первичные стандарты защищают качество питьевой воды, ограничивая уровни определенных загрязнений, которые могут неблагоприятно влиять на здоровье потребителей воды, и встречаются в общественных водопроводных сетях (табл. 2) [16].
Таблица 2
Национальные первичные нормативы питьевой воды
|
Показатели |
1MCLG 3(мг/л) |
2MCLG (мг/л) |
Потенциальное воздействие на здоровье при попадании в организм из питьевой воды |
Источники загрязнения питьевой воды |
||
|
Неорганические компоненты |
||||||
|
Сурьма |
0.006 |
0.006 |
Увеличивает в крови содержание холестерина; уменьшает содержание глюкозы |
Выбросы нефтеперегонных заводов; вещества-замедлители горения; керамика; электронные компоненты; припой |
||
|
Мышьяк |
4Нет |
0.05 |
Заболевание кожи; воздействие на кровеносную систему; увеличенный риск рака |
Выбросы при производстве полупроводников, нефтеперегонных заводов; консерванты древесины; добавки в корма; гербициды; эрозия природных отложений |
||
|
Барий
|
2 |
2 |
Увеличение кровяного давления |
Наполнители при бурении скважин; выбросы металло- аффинажных заводов; эрозия природных отложений |
||
|
Бериллий |
0.004 |
0.004 |
Заболевания кишечника |
Выбросы метало-аффинажных и коксогазовых заводов; выбросы предприятий электротехнической, аэрокосмической и оборонной промышленности |
||
|
Кадмий |
0.005 |
0.005 |
Заболевание почек |
Коррозия оцинкованных труб; эрозия природных отложений; выбросы металло-аффинажных заводов; попадание из отработанных батареек и из красок |
||
|
Хром (общий) |
0.1 |
0.1 |
Некоторые люди, использующие в течение многих лет воду, содержащую хром с содержанием более MCL, могут испытывать аллергический дерматит |
Выбросы сталелитейных и целлюлозно-бумажных заводов; эрозия природных отложений |
||
|
Медь |
1.3 |
1.3 |
Краткосрочное воздействие:желудочно-кишечное расстройство. Длительное воздействие: заболевание печени или почек |
Коррозия домашних распределительных систем; эрозия природных отложений; выделение при консервации древесины |
||
|
Цианид (как свободный цианид) |
0.2 |
0.2 |
Заболевания нервной системы или щитовидной железы |
Выбросы металло-обрабатывающих и сталелитейных заводов; выбросы заводов по выпуску пластиков или минеральных удобрений |
||
|
Свинец |
0,03 |
Уровень воздействия=0.015 |
Младенцы и дети: задержки физического или умственного развития. Взрослые: почечные заболевания; высокое кровяное давление |
Коррозия домашних распределительных систем; эрозия природных отложений |
||
|
Неорг. ртуть |
0.002 |
0.002 |
Заболевания почек |
Эрозия природных отложений; выбросы нефтеперерабатыва-ющих заводов; выделения из мусорных свалок и пахотных угодий |
||
|
Селен |
0.05 |
0.05 |
Выпадение волос и ногтей; онемение пальцев; заболевания системы кровообращения |
Выбросы нефтеперерабатыва-ющих заводов; выделения из шахт |
||
|
Таллий |
0.0005 |
0.002 |
Потеря волос; заболевания крови, почек, кишечника или печени |
Выщелачивание из рудных отвалов; выбросы электронной промышленности, заводов по производству стекла и лекарств |
||
|
Органические соединения |
||||||
|
Атразин |
0.003 |
0.003 |
Заболевания сердечно-сосудистой системы |
Поступление с гербицидами |
||
|
Бензол |
0 |
0.005 |
Анемия; уменьшение тромбоцитов крови; увеличенный риск рака |
Выбросы заводов; утечки из цистерн для хранения газов и со свалок |
||
|
Бензо(а)пирен |
0 |
0.0002 |
Увеличенный риск рака |
Выделение из футеровки цистерн для хранения воды и распределительных линий |
||
|
Четыреххлористый углерод |
0 |
0.005 |
Заболевание печени; увеличенный риск рака |
Выбросы химических заводов и других инструментальных объектов |
||
|
Хлорбензол |
0.1 |
0.1 |
Заболевания печени и почек |
Выбросы химических заводов по производству агрохимических химикатов |
||
|
1,2-дихлорэтан |
0 |
0.005 |
Увеличенный риск рака |
Выбросы с химических заводов |
||
|
1,1-дихлорэтилен |
0.007 |
0.007 |
Заболевания печени |
То же |
||
|
Цис-1,2-дихлорэтилен |
0.07 |
0.07 |
Заболевания печени |
То же |
||
|
Транс-1,2-дихлорэтилен |
0.1 |
0.1 |
Заболевания печени |
То же |
||
|
Диоксин |
0 |
0.00000003 |
Увеличенный риск рака |
Эмиссия при сжигании отходов и других видах горения; выбросы с химических заводов |
||
|
Дикват |
0.02 |
0.02 |
Катаракта |
Поступление с гербицидами |
||
|
Этилбензол |
0.7 |
0.7 |
Заболевания печени или почек |
Выбросы нефтеперегонных заводов |
||
|
Линдан |
0.0002 |
0.0002 |
Заболевания печени и желудка |
Поступление инсектицидов, применяемых при обработке пиломатериалов для коровников и в садах |
||
|
Метоксихлор |
0.04 |
0.04 |
Репродуктивные трудности |
Поступление инсектицидов, применяемых для фруктов, овощей, люцерны, домашнего скота |
||
|
Стирол |
0.1 |
0.1 |
Заболевания печени, почек и кровообращения |
Выбросы заводов по производству резинотехнических изделий и пластмасс; выделение из мусора |
||
|
Тетрахлор- этилен |
0 |
0.005 |
Заболевания печени; повышенный риск рака |
Выбросы заводов и химчисток |
||
|
Толуол |
1 |
1 |
Заболевания нервной системы, почек или печени |
Выбросы нефтеперерабатыва-ющих заводов |
||
|
Токсафен |
0 |
0.003 |
Заболевания печени, почек или щитовидной железы; повышенный риск рака |
Поступление инсектицидов, применяемых для хлопка и рогатого скота |
||
|
1,1,1-трихлорэтан |
0.2 |
0.2 |
Заболевание печени, нервной системы или системы кровообращения |
Выбросы участков обезжиривания металла и других заводов |
||
|
1,1,2-трихлорэтан |
0.003 |
0.005 |
Заболевания печени, почек или иммунной системы |
Выбросы с химических заводов |
||
|
Трихлорэтилен |
0 |
0.005 |
Заболевания печени; повышенный риск рака |
Выбросы с нефте- химических заводов |
||
|
Винилхлорид |
0 |
0.002 |
Повышенный риск рака |
Выщелачивание из поливинилхлоридных труб; выбросы заводов по производству пластмасс |
||
|
Ксилены (общее содержание) |
10 |
10 |
Заболевания нервной системы |
Выбросы с нефте- химических и химических заводов |
||
MCLG – максимальный уровень загрязнения питьевой воды, при котором не встречалось бы никакое неблагоприятное воздействие на здоровье людей. Это показатели, которых целесообразно придерживаться.
²MCLG – максимальный допустимый уровень загрязнения воды, которая поставляется любому пользователю общественной водопроводной сети.
MCL – обязательные показатели
³Значения даны в мг/л, если не указано иное.
4MCLG – для этого загрязнения не установлены
1.5. Тяжелые металлы
Тяжёлые металлы уже сейчас занимают второе место по степени опасности, уступая пестицидам и значительно опережая такие широко известные загрязнители, как двуокись углерода и серы, в прогнозе же они должны стать самыми опасными, более опасными, чем отходы АЭС и твердые отходы. Загрязнение тяжёлыми металлами связано с их широким использованием в промышленном производстве вкупе со слабыми системами очистки, в результате чего тяжёлые металлы попадают в окружающую среду, в том числе и почву, загрязняя и отравляя её.
Тяжёлые металлы относятся к приоритетным загрязняющим веществам, наблюдения за которыми обязательны во всех средах.
Количество элементов, относимых к группе тяжелых металлов, изменяется в широких пределах. В качестве критериев принадлежности используются многочисленные характеристики: атомная масса, плотность, токсичность, распространенность в природной среде, степень вовлеченности в природные и техногенные циклы. В некоторых случаях под определение тяжелых металлов попадают элементы, относящиеся к хрупким (например, висмут) или металлоидам (например, мышьяк).
На сегодняшний день к тяжелым металлам относят более 40 металлов периодической системы Д.И. Менделеева с атомной массой свыше 50 атом-ных единиц: V, Cr, Mn, Fe, Co, Ni, Cu, Zn, Mo, Cd, Sn, Hg, Pb, Bi и др.
При этом немаловажную роль в категорировании тяжелых металлов играют следующие условия: их высокая токсичность для живых организмов в относительно низких концентрациях, а также способность к биоаккумуляции и биомагнификации. Практически все металлы, попадающие под это определение (за исключением свинца, ртути, кадмия и висмута, биологическая роль, которых на настоящий момент не ясна), активно участвуют в биологических процессах, входят в состав многих ферментов.
По классификации Н.Реймерса, тяжелыми следует считать металлы с плотностью более 8 г/см3.Таким образом, к тяжелым металлам относятся Pb, Cu, Zn, Ni, Cd, Co, Sb, Sn, Bi, Hg. Формально определению тяжелые металлы соответствует большое количество элементов. Однако соединения этих элементов далеко не равнозначны как загрязняющие вещества. Поэтому во многих работах происходит сужение рамок группы тяжелых металлов, в соответствии с критериями приоритетности, обусловленными направлением и спецификой работ.
Поступление тяжелых металлов в биосферу вследствие техногенного рассеивания осуществляется разнообразными путями. Важнейшим из них является выброс при высокотемпературных процессах в черной и цветной металлургии, при обжиге цементного сырья, сжигании минерального топлива. Кроме того, источником загрязнения биоценозов могут служить орошение водами с повышенным содержанием тяжелых металлов, внесение осадков бытовых сточных вод в почвы в качестве удобрения.
Вторичное загрязнение происходит также вследствие выноса тяжелых металлов из отвалов рудников или металлургических предприятий водными или воздушными потоками, поступления больших количеств тяжелых металлов при постоянном внесении высоких доз органических, минеральных удобрений и пестицидов, содержащих тяжелые металлы.
Тяжелые металлы являются протоплазматическими ядами, токсичность которых возрастает по мере увеличения атомной массы. Их токсичность проявляется по-разному. Многие металлы при токсичных уровнях концентраций ингибируют деятельность ферментов (медь, ртуть). Некоторые из них образуют хелатоподобные комплексы с обычными метаболитами, нарушая нормальный обмен веществ (железо). Такие металлы, как кадмий, медь, железо, взаимодействуют с клеточными мембранами, изменяя их проницаемость [12].
1.5.1. Токсичность тяжелых металлов в организме
человека и животных
Токсичность – это мера несовместимости вредного вещества с жизнью. Степень токсического эффекта зависит от биологических особенностей пола, возраста и индивидуальной чувствительности организма; строения и физико-химических свойств яда; количества попавшего в организм вещества; факторов внешней среды (температура, атмосферное давление) [12].
Всемирной организацией здравоохранения (ВОЗ) в рамках Международной программы химической безопасности опубликованы «Гигиенические критерии состояния окружающей среды» для Hg, Be, Pb, Sn, Mn, Ti и других металлов.
Таблица 3
Отнесение химических веществ, попадающих в воду
из выбросов, сбросов, отходов к классам опасности
|
Класс опасности |
Химическое вещество |
|
I |
Мышьяк, кадмий, ртуть, свинец, селен, цинк, фтор |
|
II |
Бор, кобальт, никель, молибден, медь, сурьма, хром |
|
III |
Барий, ванадий, вольфрам, марганец, стронций |
Все источники поступления поллютантов (загрязнителей) можно разделить на природные и антропогенные. Среди природных источников поступления тяжелых металлов в атмосферу выделяются ветровая эрозия, извержения вулканов, лесные пожары, испарение с поверхности почв и растений, поступление с поверхности почвы и другие.
Причем для Cd, Zn и Pb доля антропогенных поступлений в атмосферу значительно превышает природные (табл.4) [19].
Таблица 4
Поступление тяжелых металлов в атмосферу (%)
|
Источник |
Кадмий |
Цинк |
Свинец |
Ртуть |
|
Общий природный источник |
26.3 |
29.0 |
4.5 |
81.0 |
|
Антропогенный Источник |
73.7 |
71.0 |
95.5 |
19.0 |
Особую опасность для окружающей среды представляют распределенные в пространстве источники тяжелых металлов, так как именно они загрязняют сравнительно большие территории. К этой группе относятся: автомобильный транспорт, сельскохозяйственные угодья (после обработки содержащими металлы пестицидами), домашние печи, использующие уголь.
На предприятиях железнодорожного транспорта источниками поступления тяжелых металлов в окружающую среду служат котельные, участки сварки и резки, химической и электрохимической обработки металлов, аккумуляторные, медницкие отделения. Тяжелые металлы поступают также при потерях перевозимого сырья и руд, в составе сточных вод предприятий [20].
Особый интерес для экологических исследований представляют Cd, Pb и Hg, относящиеся к металлам первого класса опасности.
1.5.2. Предельно допустимая концентрация
химических веществ
Предельно допустимая концентрация (ПДК) - количество вредного вещества в окружающей среде, отнесенное к массе или объему ее конкретного компонента, которое при постоянном контакте или при воздействии за определенный промежуток времени практически не влияет на здоровье человека и не вызывает неблагоприятных последствий у его потомства.
Однако существующая система ПДК недостаточно достоверно информативна, поскольку предусматривает определение индивидуального токсиканта, дистанцируясь от вопроса о комплексном воздействии различных загрязнителей. Между тем, совместное действие, например, органокомплексов тяжелых металлов кардинально меняет ПДК, экспериментально полученные для отдельного тяжелого металла [21].
Таблица 5
Предельно допустимые концентрации токсикантов
в объектах окружающей природной среды
|
Показатели |
Единицы измерения |
Нормативы (предельно допустимые концентрации (ПДК)), не более |
Показатель вредности1) |
Класс опасности |
|
Обобщенные показатели |
||||
|
Водородный показатель |
Единицы рН |
в пределах 6-9 |
|
|
|
Общая минерализация |
мг/л |
1000 (1500) 2) |
|
|
|
Жесткость общая |
Ммоль/л |
7,0 (10)2) |
|
|
|
Окисляемость перманганатная |
мг/л |
5,0 |
|
|
|
Нефтепродукты, суммарно |
мг/л |
0,1 |
|
|
|
Поверхностно – активные вещества (ПАВ), анионоактивыные |
мг/л |
0,5 |
|
|
|
Фенольный индекс |
мг/л |
0,25 |
|
|
|
Неорганические вещества |
|
|
|
|
|
Алюминий |
мг/л |
0,5 |
с.-т. |
2 |
|
Барий |
-"- |
0,1 |
-"- |
2 |
|
Бериллий |
-"- |
0,0002 |
-"- |
1 |
|
Бор (суммарно) |
-"- |
0,5 |
-"- |
2 |
|
Железо (суммарно) |
-"- |
0,3 (1,0)2) |
орг. |
3 |
|
Кадмий (суммарно) |
-"- |
0,001 |
с.-т. |
2 |
|
Марганец (суммарно) |
-"- |
0,1 (0,5)2) |
орг. |
3 |
|
Медь (суммарно) |
-"- |
1,0 |
-"- |
3 |
|
Молибден (суммарно) |
-"- |
0,25 |
с.-т. |
2 |
|
Мышьяк (суммарно) |
-"- |
0,05 |
с.-т. |
2 |
|
Никель (суммарно) |
мг/л |
0,1 |
с.-т. |
3 |
|
Нитраты |
-"- |
45 |
орг. |
3 |
|
Ртуть (суммарно) |
-"- |
0,0005 |
с.-т. |
1 |
|
Свинец (суммарно) |
-"- |
0,03 |
-"- |
2 |
|
Селен (суммарно) |
-"- |
0,01 |
-"- |
2 |
|
Сронций |
-"- |
7,0 |
-"- |
2 |
|
Сульфаты |
-"- |
500 |
орг. |
4 |
Примечания:
1) Лимитирующий признак вредности вещества, по которому установлен норматив: "с.-т. "- санитарно-токсикологический, "орг. "- органолептический;
2) Величина, указанная в скобках, может быть установлена по постановлению главного государственного санитарного врача по соответствующей территории для конкретной системы водоснабжения на основании оценки санитарно-эпидемиологической обстановки в населенном пункте и применяемой технологии водоподготовки;
3) Нормативы приняты в соответствии с рекомендациями ВОЗ.
1.5.3. Влияние тяжелых металлов на организм человека
Тяжелые металлы (ксенобиотики) занимают одно из первых мест по токсичности среди загрязняющих веществ, содержащихся в сточных водах. К тяжелым металлам относятся более 40 химических элементов периодической системы Д.И. Менделеева, масса атомов которых составляет свыше 50 атомных единиц.
Эта группа элементов активно участвует в биологических процессах, входя в состав многих ферментов. Группа "тяжелых металлов" во многом совпадает с понятием "микроэлементы". Отсюда свинец, цинк, кадмий, ртуть, молибден, хром, марганец, никель, олово, кобальт, титан, медь, ванадий являются тяжелыми металлами. Они не подвержены биодеградации и, постепенно накапливаясь в различных компонентах экосистемы, участвуют в биоциклах. Перед тем, как попасть в организм человека тяжелые металлы проходят через ряд «инстанций». Элементы, попадая в воду рек, почву, попадают в растения, а при употреблении в пищу растительной продукции они удерживаются в органах человека и животных [18].
Эти металлы опасны тем, что способны к биоаккумуляции. Поступая вместе с пищей и жидкостями, металлы удерживаются и накапливаются в теле, как в фильтре. Организм не может освободиться от тяжёлых металлов, так как они прочно связываются с белками. Биоаккумуляция усугубляется в пищевой цепи, и организмы, находящиеся на вершине пищевой пирамиды, имеют самые высокие дозы ядохимикатов. Эта доза может стать в сто тысяч раз выше, чем во внешней среде. Такое накопление вещества при прохождении через пищевую цепь называют биоконцентрированием. Эти процессы трудно заметить на ранних стадиях до достижения опасного уровня. При достижении опасного уровня практически невозможно исправить ситуацию.
Попадание металла - токсиканта может происходить и путем аэрозольного переноса, в основном они проникают в живой организм через воду. Попав в организм, металлы - токсиканты чаще всего не подвергаются каким-либо существенным превращениям, как это происходит с органическими токсикантами, и, включившись в биохимический цикл, они крайне медленно покидают его [22].
Глава II.Экспериментальная методическая работа
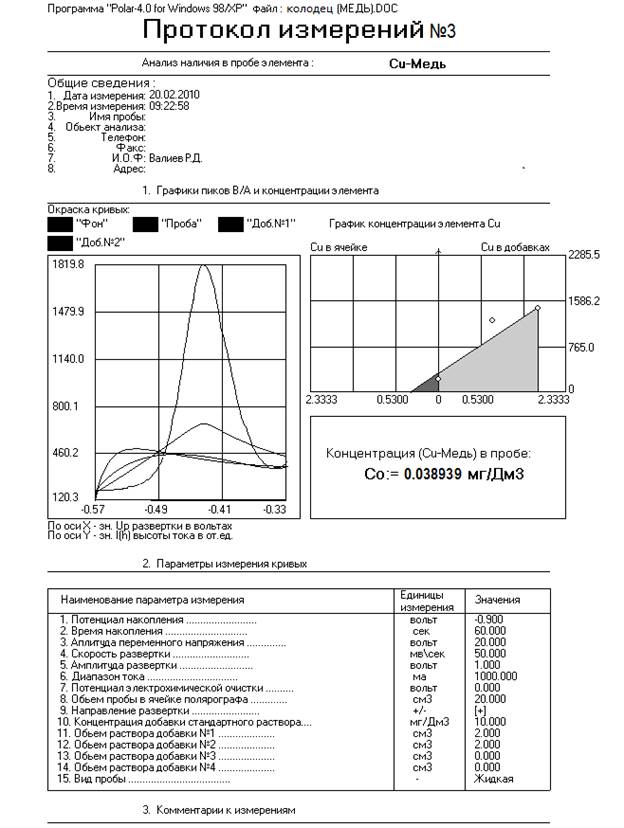
2.1. Методика выполнений измерений массовой концентрации свинца и меди в воде села Сейтяково Балтачевского района республики Башкостостан
Настоящая методика выполнения измерений устанавливает инверсионно-вольтамперометрический метод определения массовой концентрации мышьяка и ртути в пробах воды питьевой, минеральной питьевой, природной и сточной.
Метод обеспечивает получение результатов измерений массовой концентрации свинца, меди, в воде питьевой, минеральной, природной и сточной в диапазонах и с метрологическими характеристиками.
Инверсионно-вольтамперометрический метод основан на зависимости тока, проходящего через ячейку анализатора с анализируемым раствором, от массовой доли элемента, содержащегося в растворе и функционально связанного с формой и параметрами приложенного к электродам поляризующего напряжения.
Инверсионно-вольтамперометрический метод базируется на способности анализируемого элемента электрохимически накапливаться на поверхности или в объеме индикаторного (рабочего) электрода и растворяться в процессе анодной или катодной поляризации при определенном потенциале, характерном для каждого элемента.
Высота пика элемента, регистрируемого на вольтамперограмме, пропорциональна массовой доле элемента в растворе.
Процесс вольтамперометрического определения содержания элементов в инверсионном режиме включает в себя:
-электрохимическую очистку измерительного (рабочего) электрода;
-электрохимическое накопление элемента на измерительном электроде:
-электрорастворение накопленного элемента при развертке потенциала при заданных режимах.
Массовую концентрацию элемента в растворах проб после их минерализации определяют методом «стандартных добавок», не требующим построения градуировочной кривой.
«Метод стандартных добавок» основан на регистрации при одних и тех же параметрах измерений вольтамперограмм серии растворов для каждой пробы:
-фонового электролита (фона);
-пробы, подготовленной к измерениям;
-той же пробы, в которую вводят раствор-добавку измеряемого элемента, с известной массовой концентрацией.
Результаты измерений рассчитываются автоматически сравнением значений аналитических сигналов элемента на вольтамперограммах серии растворов.При подготовке к выполнению измерений выполняют следующие работы: подготовку посуды, приготовление растворов, подготовку анализатора к работе.
Измерения проводятся с помощью программного комплекса “Polar-4.0”, которая предназначена для автоматического определения содержания тяжелых металлов и других элементов в водных средах методом инверсионной вольтамперометрии (ИВА) с применением комплекса ИВА-400МК, в состав которого входит программа “Polar-4.0”. Данная программа работает с компьютерным полярографом, реализованный на базе датчика АКВ-07. Благодаря этому весь процесс измерения автоматизирован.
Программа обеспечивает измерение, обработку данных, создание протокола измерений, хранение, поиск и анализ протоколов измерения для следующих тяжелых металлов и некоторых веществ, не относящихся к тяжелым металлам: Сd, Cu, Zn, Pb, Hg, Vi, Fe, As, Сернистая кислота.
Порядок подготовки к измерениям
При подготовке к выполнению измерений выполняют следующие работы: подготовку посуды, приготовление растворов, подготовку анализатора к работе.
2.2. Подготовка посудыНовую и загрязненную посуду тщательно промывают хромовой смесью, затем многократно споласкивают водопроводной водой, несколько раз - дистиллированной водой .
При выполнении измерений непосредственно перед использованием подготовленную посуду дополнительно промывают раствором азотной кислоты с молярной концентрацией 1 моль и тщательно ополаскивают дистиллированной водой.
2.3. Приготовление растворов
2.3.1. Приготовление раствора соляной кислоты с молярной
концентрацией 1моль
В мерную колбу вместимостью 1 л наливают немного дистиллированной воды и осторожно цилиндром приливают 165 мл концентрированной соляной кислоты ( плотностью 1,185 г/см3). Раствор перемешивают и после охлаждения доводят до метки дистиллированной водой.
2.3.2. Приготовление раствора трилона Б молярной концентрации
0,1 моль
Трилон Б помещают в мерную колбу вместимостью 250 мл и растворяют в дистиллированной воде, после чего содержимое колбы доводят до метки и перемешивают.
2.3.3. Приготовление насыщенного раствора хлористого калия
Хлорид калия растворяют при нагревании в 150 мл дистиллированной воды до насыщения. Горячий раствор фильтруют и охлаждают до комнатной температуры. Раствор хранят в контакте с выпавшими кристаллами соли.
2.3.4. Приготовление раствора азотной кислоты с молярной
концентрацией 1моль
В мерную колбу вместимостью 1 л, добавляют 500 мл дистиллированной воды, цилиндром вместимостью 100мл вносят 62 мл концентрированной азотной кислоты (плотностью 1,42 г/см3) и доводят объем раствора до метки дистиллированной водой.
2.3.5. Приготовление аттестованных растворов ионов меди,
свинца с массовой концентрацией каждого элемента 10,0 мг/лРастворы ионов свинца и меди готовят раздельно. Вскрывают стеклянную ампулу ГСО соответствующего иона, выливают содержимое в сухой стакан. Пипеткой объемом 5,0 мл переносят 5,0 мл раствора ГСО в мерную колбу объемом 50 мл и доводят объем раствора до метки дистиллированной водой.
2.3.6. Приготовление растворов-добавок ионов, свинца и меди с массовой концентрацией 10,0 мг/ мл
Растворы-добавки готовят отдельно для каждого элемента разбавлением дистиллированной водой соответствующих растворов, приготовленных по 2.3.5.Емкость мерных колб, объем аттестованных растворов, массовая концентрация элементов в растворах-добавках и сроки хранения приведены в таблице 6.Таблица 6Емкость, объем, концентрация и сроки хранения растворов - добавок
Массоваяконцентрациярастворамг/дм |
Объемисходногорастворасм3 |
Вместимостьмерной колбы.см3 |
Массовая концентрация раствора-добавки мг'дм"' |
Срок хранения |
100 |
5 |
50 |
10.0 |
30 дней |
2.4. Приготовление фонового электролита
Раствора фона готовят перед регистрацией вольтамперограмм. Дистиллированную воду объемом 20 мл пипеткой переносят в выпарительную чашку, добавляют 1 мл концентрированной азотной кислоты и осторожно, не допуская разбрызгивания, упаривают содержимое чашки на песчаной бане до "влажных солей".
После охлаждения содержимое чашки растворяют в 1 мл раствора соляной кислоты с молярной концентрацией 1 моль и добавляют 1 мл раствора трилона Б с молярной концентрацией 0,1 моль, тщательно перемешивают и количественно переносят в мерную колбу вместимостью 25 мл. Содержимое колбы доводят до метки дистиллированной водой.
2.5. Подготовка проб к анализу Для проведения измерений были отобраны пробы:- р. Танып – проба бралась с реки Танып протекающая вдоль с. Сейтяково;
- вода с колодца - проба бралась с колодца жилого дома с. Сейтяково;
- р. Кигазы – проба бралась с реки Кигазы протекающая в с. Сейтяково.
Пробу питьевой воды объемом 20 мл пипеткой переносят в выпарительную чашку, добавляют 1 мл концентрированной азотной кислоты и осторожно, не допуская разбрызгивания, упаривают содержимое чашки на песчаной бане до "влажных солей". К анализу готовят две параллельные пробы.
После охлаждения содержимое чашки растворяют в 1 мл раствора соляной кислоты с молярной концентрацией 1 моль и добавляют 1 мл раствора трилона Б с молярной концентрацией 0,1 моль, тщательно перемешивают и количественно переносят в мерную колбу вместимостью 25 мл. Содержимое колбы доводят до метки дистиллированной водой.
Раствор фона объемом 20 мл переносят пипеткой вместимостью 20 мл в стеклоуглеродный тигель, закрепляют на подставке-держателе анализатора. В соответствии с программой анализатора «POLAR» устанавливают значения параметров измерений и регистрируют вольтамперограммы определяемого в пробе элемента. Количество регистрируемых вольтамперограмм устанавливают не менее трех (графа «циклы» программы).
2.6. Порядок измерений
В соответствии с руководством пользователя программы «POLAR» вольтамперограммы для каждого раствора серии (фон, проба или проба с добавками) усредняют. В/А, отличающиеся по высоте пика определяемого элемента между собой более чем на 20% удаляют.
2.6.1. Регистрация вольтамперограмм растворафонового электролита (фона)В стекло-углеродный тигель пипеткой объемом 20 см3 помещают 20 см3 раствора фонового электролита, закрепляют на подставке-держателе анализатора, устанавливают параметры измерений и регистрируют вольтамперограммы свинца и меди.2.6.2. Регистрация вольтамперограмм пробыПробу объемом 20 мл, подготовленную к измерениям по 2.5, пипеткой объемом 20 мл помещают в стеклоуглеродный тигель и закрепляют его на подставке-держателе анализатора. Регистрируют вольтамперограммы по 2.5.1.2.6.3. Регистрация вольтамперограмм пробыс растворами-добавками ионов свинца и медиПосле регистрации вольтамперограмм пробы в стеклоуглеродный тигель дозатором пипеточным переменного объема вносят раствор-добавку соответствующего иона, приготовленный по 2.3.5, и регистрируют вольтамперограммы по 2.5.1.2.6.4. Очистка электродовПо окончании работы электроды тщательно промывают дистиллированной водой: рабочий электрод (АКУ-1) очищают механически сухой фильтровальной бумагой, а затем бумагой, смоченной спиртом этиловым. При необходимости электрод шлифуют окисью алюминия, затем промывают дистиллированной водой и высушивают фильтровальной бумаги. Электрод сравнения помешают в емкость с насыщенным раствором хлорида калия.2.7. Обсуждение протоколов измеренийПо выше указанной методике были проведены опыты и получены результаты, которые представлены в таблице 7, протоколах измерений (1-6), а также в рисунках 4 и 5. Таблица 7 Результаты
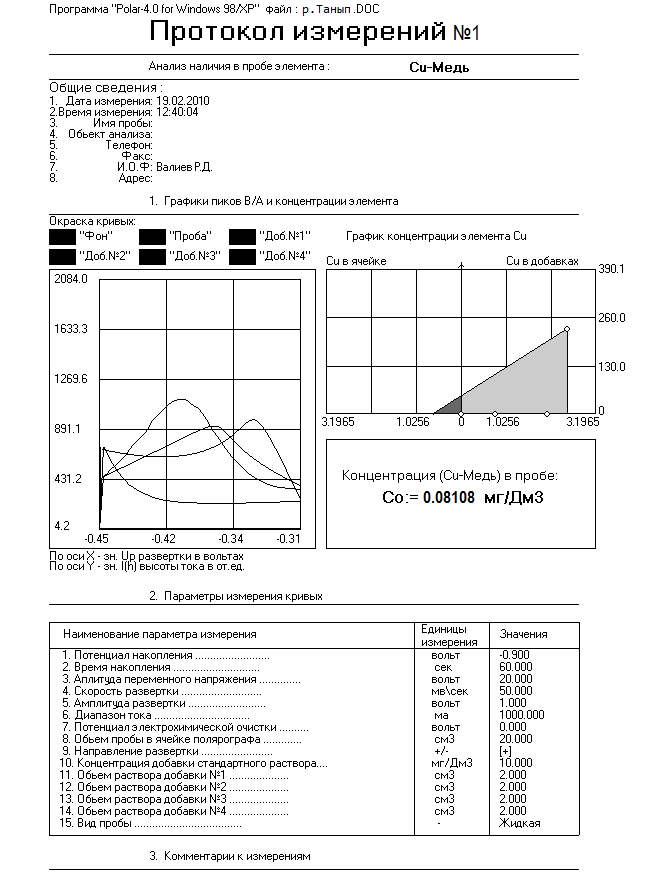
|
Место взятия пробы |
Содержание в воде меди в мг/дм3 |
Содержание в воде свинца в мг/дм3 |
|
р. Танып |
0,08108 |
0,006180 |
|
р. Кигазы |
0,01963 |
0,001076 |
|
Колодец |
0,03893 |
0,001019 |
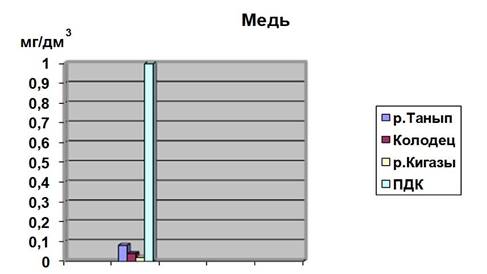
Рис.4. Содержание меди в анализируемых пробах
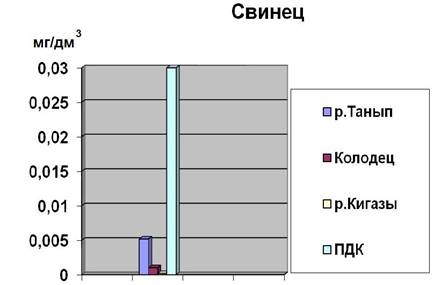
Рис.5. Содержание свинца в анализируемых пробах
Исходя из полученных результатов видно, что концентрация Cu в воде, взятая с реки Танып не превышает ПДК и составляет 8,1% по сравнению с ней. Отсюда можно сделать вывод, что вода умеренно загрязнена Cu.

Исходя из полученных результатов видно, что концентрация Pb в воде, взятого с реки Танып не превышает ПДК и составляет 20,6% по сравнению с ней. Отсюда можно сделать вывод, что вода умеренно загрязнена Pb и пригодна для использования.
Исходя из полученных результатов видно, что концентрация Cu в воде, взятого из колодца не превышает ПДК и составляет 3,8% по сравнению с ней. Отсюда можно сделать вывод, что вода умеренно загрязнена Cu и пригодна для питья.
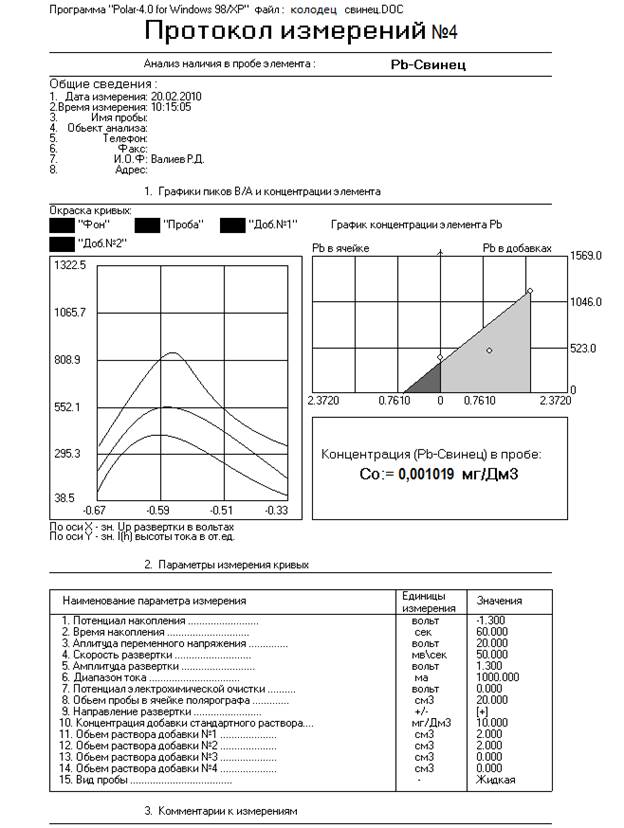
Исходя из полученных результатов видно, что концентрация Pb в воде, взятого из колодца не превышает ПДК и составляет 3,3% по сравнению с ней. Отсюда можно сделать вывод, что вода умеренно загрязнена Pb и пригодна для питья.
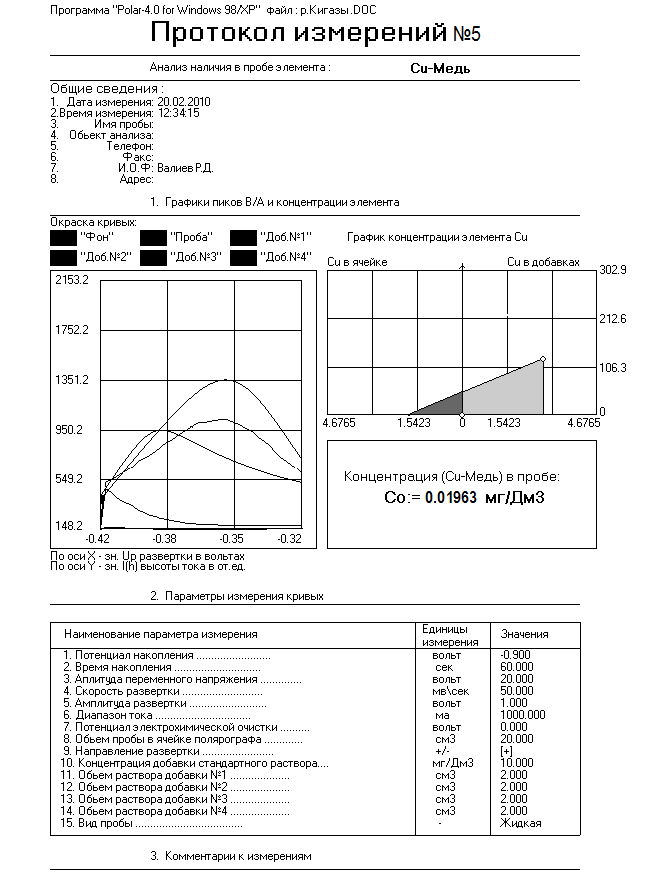
Исходя из полученных результатов видно, что концентрация Cu в воде, взятая с реки Кигазы не превышает ПДК и составляет 1,9% по сравнению с ней. Отсюда можно сделать вывод, что вода умеренно загрязнена Cu.
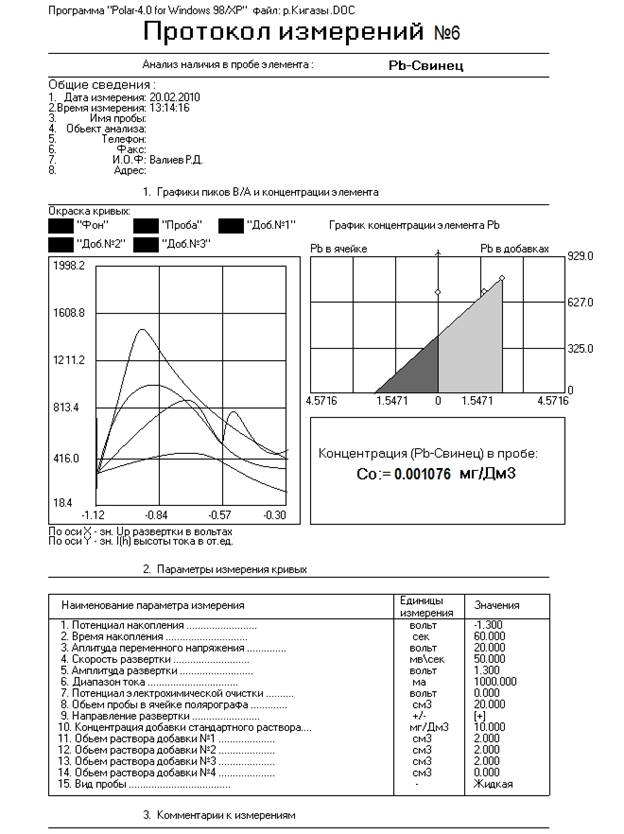
Исходя из полученных результатов видно, что концентрация Pb в воде, взятого с реки Кигазы не превышает ПДК и составляет 3,5% по сравнению с ней. Отсюда можно сделать вывод, что вода умеренно загрязнена Pb и пригодна для использования.
Заключение
В ходе выполнения работы была изучена и проанализирована традиционная методика измерений массовой доли тяжелых металлов методом инверсионной вольтамперометрии, которая проводилась с помощью программного комплекса “Polar-4.0”, с автоматическим определением содержания тяжелых металлов. В протоколах измерений перечислены параметры измерений, а также представлены результаты исследований:
-р.Танып: концентрация Cu в воде не превышает ПДК и составляет 8,1% по сравнению с ней. Отсюда можно сделать вывод, что вода умеренно загрязнена Cu;
-р.Танып: концентрация Pb в воде не превышает ПДК и составляет 20,6% по сравнению с ней. Отсюда можно сделать вывод, что вода умеренно загрязнена Pb и пригодна для использования;
-колодец: концентрация Cu в воде не превышает ПДК и составляет 3,8% по сравнению с ней. Отсюда можно сделать вывод, что вода умеренно загрязнена Cu и пригодна для питья;
-колодец: концентрация Pb в воде не превышает ПДК и составляет 3,3% по сравнению с ней. Отсюда можно сделать вывод, что вода умеренно загрязнена Pb и пригодна для питья;
-р.Кигазы: концентрация Cu в воде не превышает ПДК и составляет 1,9% по сравнению с ней. Отсюда можно сделать вывод, что вода умеренно загрязнена Cu;
-р.Кигазы: концентрация Pb в воде не превышает ПДК и составляет 3,5% по сравнению с ней. Отсюда можно сделать вывод, что вода умеренно загрязнена Pb и пригодна для использования.
В результате эксперимента получили то, что в естественных и искусственных водоемах села Сейтяково содержания тяжелых металлов не превышает норм ПДК. Это связано тем что, является практически экологически чистым стационаром в связи с неразвитой промышленностью.
Литература
1. Проблемы экологии: Принципы и решения на примере Южного Урала/ под ред. Н.В. Старовой. – М.: Наука. 2003.
2. Голицын А.Н. Основы промышленной экологии: Учеб. для проф. образования. – М.: Академия, 2002. – 240 с.
3. Хаматнуров Н.М., Исмагилов А.М. Балтачевский район.-2004.
4. Байкишев Н.А. Бирск – Уфа. Кн. Изд. 2002.
5. Фиалков Ю.Я. Необычные свойства обычных растворов. – М.: Педагогика, 2004. – 112 с
6. Экологический мониторинг / Т.Я.Ашихмина, Г.Я.Кантор,
А.Н.Васильева.- М.,2006.
7. Фаткуллин Р.А. Природные условия Башкортостана. – Уфа: Китап, 2003.
8. Харабрин А.В. Экологический мониторинг качества воды и оценка. – Уфа – 2004.
9. Шустов С.Б., Шустова Л.В. Химические основы экологии: Учебное пособие с углубленным изучением химии, биологии и экологии. – М.: Просвещение, 2000. – 239 с.
10. Голицын А.Н. Основы промышленной экологии: Учеб. для проф.
образования. – М.: Академия, 2002. – 240 с.
11. Морозов Н.П. Загрязнения мирового океана тяжелыми металлами (новые
взгляды на проблему). // Журнал ВХО им. Д.И. Менделеева, 2001, Т. 35,
№5, с.640-649.
12. Некоторые вопросы токсичности ионов металлов. Под ред. Х. Зигель.- М.:
Мир, 2002. – 266 с.
13. Мазаев В.Т., Мандрыгин В.И. Контроль качества питьевой воды. – М.Колос, 2000. – 168с.
14. Руководство по контролю качества питьевой воды: Т.1. Рекомендации. Т.2. Гигиенические критерии и другая релевантная информация. – М.: Медицина – ВОЗ, 2004-2006. – 570 с.
15. Фомин Г.С. Вода. Контроль химический, бактериальной и радиационной безопасности по международным стандартам. Энциклопедический справочник. – 3-е изд., перераб. И доп. – М.: Протектор, 2000. – 848 с.
16. Мазаев В.Т., Мандрыгин В.И. Контроль качества питьевой воды. – М.:
Колос, 2000. – 168с.
17. Государственный стандарт Российской Федерации. Вода питьевая. Общие
требования к организации и методам контроля качества. – М., 2006.
18. Васильев В.П. Аналитическая химия: В 2-х кн.: Кн. 1: Титриметрические и гравиметрический методы анализа. – 3-е изд. – М.: Дрофа, 2003. – 368 с.
19. Дерпгольц В.Ф. Мир воды. – Л.: Недра, 2000. – 254с.
20. Кумсиашвили Г. П. Гидроэкологический потенциал водных ресурсов.
Академкнига, 2005 г.
21. Экологическая доктрина Российской Федерации. Официальный сайт государственной службы охраны окружающей природной среды России- http://www.eco-net.ru/
22. Глава из книги "Как организовать общественный экологический мониторинг" под редакцией М.В. Хотулевой. Сайт методического центра "Эколан" - http://www.ecoline.ru/
Приложение

Рис.6. Река Танып

Рис.7. Река Кигазы

Рис.8. Колодец (с. Сейтяково)

Рис.9. “Polar-4.0”
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.