
Областное государственное бюджетное
профессиональное образовательное учреждение
«Рославльский медицинский техникум»
|
Рассмотрено на заседании ЦМК специальности 33.02.01 Фармация Протокол № ___ от «___» __________2024 г. _______________ Т.А. Вишневская |
УТВЕРЖДАЮ И.о. зам. директора по УМР ОГБПОУ «Рославльский медицинский техникум» _______________ С.В. Новикова «___» _______________ 2024 г. |
Контроль качества
таблетированных лекарственных форм
Учебно-методическое пособие
по МДК 02.02 Контроль качества лекарственных средств
для обучающихся специальности 33.02.01 Фармация
Автор: Т.А. Вишневская,
заведующий отделением
специальности 33.02.01 Фармация,
преподаватель профессионального цикла
Рославль
2024
СОДЕРЖАНИЕ
|
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА.…………………………………………… |
4 |
|
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ. КОНТРОЛЬ КАЧЕСТВА ТАБЛЕТИРОВАННЫХ ЛЕКАРСТВЕННЫХ ФОРМ…………………… 1.1. Таблетки как лекарственная форма. Общая характеристика……………. 1.2. Формирование показателей качества таблетированных лекарственных форм……………………………………………........................ 1.3. Нормативные документы, регламентирующие производство и контроль качества таблеток………………….......................... ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ……………………………………… ПРАКТИЧЕСКАЯ ЧАСТЬ. КОНТРОЛЬ КАЧЕСТВА ТАБЛЕТИРОВАННЫХ ЛЕКАРСТВЕННЫХ ФОРМ (на примере таблеток ацетилсалициловой кислоты отечественного производства)………………………………………………. 2.1. Стандартизация таблеток ацетилсалициловой кислоты. Отечественные и зарубежные производители………………………………. 2.2. Физико-химическая природа и методы химического контроля качества таблеток ацетилсалициловой кислоты………………… 2.3. Контроль качества таблеток ацетилсалициловой кислоты различных отечественных производителей. Практическое задание………. СИТУАЦИОННЫЕ ЗАДАЧИ…………………………………………...…... СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ………………………... ПРИЛОЖЕНИЕ……………………………………………………………….. |
9 9
13
17 29
30
30
36
41 48 49 51 |
СПИСОК СОКРАЩЕНИЙ
АО – Акционерное общество
ВЭЖХ – высокоэффективная жидкостная хроматография
ГФ – Государственная фармакопея
ЗАО – Закрытое акционерное общество
ИК – инфракрасный
ИЮПАК (англ. International Union of Pure and Applied Chemistry, IUPAC) – Международный союз теоретической и прикладной химии
ОАО – Открытое акционерное общество
ОФС – Общая фармакопейная статья
ПФ – подвижная фаза
ПФК – Производственная фармацевтическая компания
УФ – ультрафиолетовый
ФС – Фармакопейная статья
ФСП – Фармакопейная статья предприятия
ХФЗ – химико-фармацевтический завод
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Междисциплинарный курс МДК 02.02 Контроль качества лекарственных средств является разделом профессионального модуля ПМ.02 Изготовление лекарственных препаратов в условиях аптечных организаций и ветеринарных аптечных организаций. Его рабочая программа разработана на основе Федерального государственного образовательного стандарта по специальности среднего профессионального образования 33.02.01 Фармация, утвержденного Приказом Минпросвещения России от 13 июля 2021 г. № 449.
Результатом освоения МДК 02.02 Контроль качества лекарственных средств является освоение соответствующих профессиональных компетенций (ПК) и общих (ОК) компетенций.
Одним из действенных методов организации учебного процесса, способствующего достижению поставленных целей и задач, а также повышения качества подготовки специалистов со средним медицинским и фармацевтическим образованием, является разработка и внедрение в образовательный процесс учебно-методических пособий. По каждому разделу МДК 02.02 Контроль качества лекарственных средств разработаны методические указания и учебно-методические пособия для студентов в соответствии с требованиями Федеральных государственных образовательных стандартов нового поколения и современного рынка труда.
Учебно-методическое пособие «Контроль качества таблетированных лекарственных форм» состоит из двух разделов (теоретического и практического) и содержит подробное описание работ по контролю качества таблетированных лекарственных форм, необходимые для изучения и закрепления теоретического материала и приобретения практических навыков фармацевтического анализа рассматриваемых лекарственных форм.
В учебно-методическом пособии рассмотрен контроль качества таблетированных лекарственных форм на примере таблеток ацетилсалициловой кислоты.
Учебно-методическое пособие включает задания для самоподготовки и самоконтроля, а также приложения, необходимые для оформления результатов контроля качества и протоколов анализа.
Учебно-методическое пособие предназначено для самостоятельной подготовки студентов отделения специальности 33.02.01 Фармация к теоретическим и практическим занятиям, выполнения практических заданий в аудиторное время с целью овладения профессиональными и общими компетенциями согласно требований Федерального государственного образовательного стандарта по специальности среднего профессионального образования 33.02.01 Фармация.
Методики контроля качества могут быть рекомендованы для использования в работе провизоров-аналитиков контрольно-аналитических лабораторий и отделов контроля качества лекарственных средств.
Актуальность. В номенклатуре современных лекарственных препаратов таблетированные лекарственные формы занимают особое место. Таблетки являются наиболее распространенной лекарственной формой промышленного производства благодаря ряду достоинств: точность дозирования вводимых в таблетки лекарственных средств, портативность, удобство применения, хранения, транспортировки и др.
Таблетки отличаются большим разнообразием как по форме, размерам и массе, так и по технологии получения, способу применения и кинетике высвобождения действующего вещества. Поэтому к таблетированным лекарственным препаратам предъявляют высокие требования. Оценка качества таблеток включает показатели качества, характеризующие действующие и, при необходимости, вспомогательные вещества, а также показатели качества, характеризующие саму лекарственную форму. Показатели качества должны гарантировать качество, эффективность, безопасность, стабильность при хранении и применении таблеток.
Настоящее учебно-методическое пособие разработано с целью освоения контроля качества лекарственных препаратов в форме таблеток. В пособии определены показатели качества таблетированных лекарственных форм с учетом технологии производства и требований, предъявляемых действующей нормативной документацией.
Пример лабораторного контроля качества рассматриваемых лекарственных форм с полным теоретическим обоснованием хода анализа и расчетной аргументацией приведен на примере таблеток ацетилсалициловой кислоты 500 мг отечественного производства.
Для контроля и самоконтроля освоения материала приводятся контрольные вопросы, тестовые задания, ситуационные задачи.
Цель: определить показатели качества таблетированных лекарственных форм согласно действующей нормативной документации; осуществить контроль качества рассматриваемых лекарственных форм на примере таблеток ацетилсалициловой кислоты различных отечественных промышленных производителей.
Задачи:
1) научиться давать характеристику твердых лекарственных форм – таблеток;
2) определить показатели качества таблетированных лекарственных форм согласно действующей нормативной документации, регламентирующей их производство и контроль качества;
3) осуществить анализ ассортимента таблеток ацетилсалициловой кислоты отечественного производства и требований, предъявляемых к рассматриваемым лекарственным препаратам, реализуемым в РФ;
4) рассмотреть физико-химическую природу ацетилсалициловой кислоты и установить методы контроля качества таблетированных лекарственных форм данного лекарственного средства;
5) осуществить контроль качества таблеток ацетилсалициловой кислоты различных отечественных промышленных производителей;
6) сделать заключение о качестве рассматриваемых лекарственных препаратов, оформить протоколы контроля качества.
В результате самоподготовки и теоретических занятий студент должен знать:
- общую характеристику и классификацию твердых лекарственных форм – таблеток;
- требования и показатели качества, предъявляемые к таблетированным лекарственным формам согласно действующей нормативной документации, регламентирующей их производство и контроль качества;
- химическую формулу, физико-химические свойства ацетилсалициловой кислоты, реакции определения подлинности и методы количественного определения рассматриваемого лекарственного средства;
- условия хранения и применение в медицинской практике таблеток ацетилсалициловой кислоты.
В результате самоподготовки, теоретических и практических занятий студент должен уметь:
- давать общую характеристику таблеток и классифицировать их;
- определять показатели качества таблетированных лекарственных форм согласно действующей нормативной документации;
- применять методики качественного и количественного определения лекарственных средств в таблетированных лекарственных формах, исходя из их состава и имеющихся в лаборатории оборудования и реактивов;
- осуществлять контроль качества таблетированных лекарственных форм на примере таблеток ацетилсалициловой кислоты различных отечественных промышленных производителей;
- соблюдать правила охраны труда и техники безопасности при работе в лаборатории контроля качества лекарственных средств ОГБПОУ «Рославльский медицинский техникум».
ПЕРЕЧЕНЬ ОБЩИХ И ПРОФЕССИОНАЛЬНЫХ КОМПЕТЕНЦИЙ,
КОТОРЫМИ ДОЛЖЕН ОВЛАДЕТЬ СТУДЕНТ
ПО ИТОГАМ ВЫПОЛНЕНИЯ ПРАКТИЧЕСКОЙ ЧАСТИ
Перечень общих компетенций
|
Код |
Наименование общих компетенций |
|
ОК 01. |
Выбирать способы решения задач профессиональной деятельности применительно к различным контекстам |
|
ОК 02. |
Осуществлять поиск, анализ и интерпретацию информации, необходимой для выполнения задач профессиональной деятельности |
|
ОК 03. |
Планировать и реализовывать собственное профессиональное и личностное развитие |
|
ОК 04. |
Работать в коллективе и команде, эффективно взаимодействовать с коллегами, руководством, клиентами |
|
ОК 05. |
Осуществлять устную и письменную коммуникацию на государственном языке РФ с учетом особенностей социального и культурного контекста |
|
ОК 07. |
Содействовать сохранению окружающей среды, ресурсосбережению, эффективно действовать в чрезвычайных ситуациях |
|
ОК 09. |
Использовать информационные технологии в профессиональной деятельности |
|
ОК 10. |
Пользоваться профессиональной документацией на государственном и иностранном языках |
Перечень профессиональных компетенций
|
Код |
Наименование видов деятельности и профессиональных компетенций |
|
ПК 2.3. |
Владеть обязательными видами внутриаптечного контроля лекарственных средств |
|
ПК 2.4. |
Оформлять документы первичного учета по изготовлению лекарственных препаратов |
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ. КОНТРОЛЬ КАЧЕСТВА ТАБЛЕТИРОВАННЫХ ЛЕКАРСТВЕННЫХ ФОРМ
1.1. Таблетки как лекарственная форма.
Общая характеристика
Таблетки (Тabulettae) – это твердая дозированная лекарственная форма, получаемая прессованием порошков и гранул, содержащих одно или более лекарственных веществ с добавлением или без вспомогательных веществ или получаемая формованием специальных масс. Они могут быть предназначены для внутреннего, наружного, сублингвального, имплантационного или парентерального применения.
Долгое время лекарственные средства изготавливали и принимали преимущественно в виде порошков или капель, пока в 1880 г. Уильям Апджон не предложил изготавливать лекарства в виде таблеток. Через четыре года он создал машину для таблетирования лекарств, а в 1886 г. основал компанию Upjohn Pill and Granule Company по производству таблеток, просуществовавшую более века.
Благодаря наличию ряда положительных качеств таблетки являются наиболее распространенной лекарственной формой промышленного производства. К положительным качествам таблеток относятся:
- возможность полной механизации процесса изготовления, обеспечивающей высокую производительность, чистоту и гигиеничность лекарственной формы;
- точность дозирования вводимых в таблетки лекарственных и вспомогательных веществ;
- портативность таблетированных лекарственных форм, обеспечивающая удобство их отпуска, хранение и транспортировку;
- относительно длительная сохранность лекарственных веществ в спрессованном состоянии в таблетированных лекарственных формах;
- маскировка неприятных органолептических свойств лекарственных веществ в таблетированных лекарственных формах (вкус, запах, красящая способность);
- возможность локализации и пролонгирования действия лекарственного вещества.
Выбор оптимальной технологической схемы производства таблетированных лекарственных форм зависит от физико-химических и технологических свойств лекарственных веществ, их количества в составе таблетки, устойчивости к воздействию факторов внешней среды и др. и включает, как правило, несколько стадий:
- подготовка и отвешивание лекарственных и вспомогательных веществ;
- смешивание компонентов, входящих в состав таблеток;
- гранулирование;
- дозирование и прессование;
- упаковка;
- маркировка.
Согласно общей схемы производства таблетированных лекарственных форм, первой стадией является отвешивание действующих и вспомогательных веществ: на весоизмерительных приборах производят отвешивание всех компонентов таблетки, отвечающих требованиям нормативной документации (при необходимости их порошки измельчают на дезинтеграторе).
В зависимости от физико-химических свойств лекарственных веществ, их дозировки и метода получения применяют связующие вещества, разбавители, разрыхлители, скользящие и смазывающие вещества, красители и другие группы вспомогательных веществ, разрешенные к медицинскому применению. Связующие вещества применяют для грануляции и обеспечения необходимой прочности таблеток при прессовании.
В качестве вспомогательных веществ чаще всего используют альгиновую кислоту и ее натриевую соль, ацетилцеллюлозу, ацетилфталилцеллюлозу и ее натриевую соль, аэросил, воду, воск, гликоколь, глюкозу, декстрин, желатин, индигокармин, какао, кальция карбонат, кальция фосфат двузамещенный, каолин, карбоксиметилцеллюлозу и ее натриевую соль, кислоты винную, лимонную, стеариновую и ее соли, крахмал, магния карбонат, магния оксид, маннит, метилцеллюлозу, микрокристаллическую целлюлозу, муку пшеничную, натрия гидрокарбонат, натрия хлорид, оксипропилцеллюлозу, оксипропилметилцеллюлозу, поливинилпирролидон, полиэтиленгликоль, природные камеди, сахар молочный, сорбит, твин-80, титана двуокись и др.
На следующей стадии производства таблеток – стадии измельчения – происходит достижение однородности смешения действующих и вспомогательных веществ, устранение крупных агрегатов, увеличение технологических и биологических эффектов. Эта стадия производства таблетированных лекарственных форм также позволяет переработать некондиционные таблетки. Далее все компоненты по отдельности просеивают и засыпают в бункер, откуда он поступает на сито. Готовый продукт (просев и отсев) поступает в разные лотки, затем ссыпается с конвейера в заранее подготовленные тары.
В аппарат для смешения подают порошок действующего вещества для проведения влажного гранулирования и сушки. Далее гранулят поступает на опудривание. Опудривающая смесь состоит из крахмала (из общего рассчитанного количества вычитают количество, использованное в качестве связывающего вещества) и кроскармеллоза натрия. В процессе опудривания добавляют разрыхляющие вещества (крахмал) для обеспечения необходимой распадаемости таблеток и растворения лекарственных средств.
Процесс опудривания происходит в машине-опудривателе. Готовые таблетки подаются в приемную тару для последующего обеспыливания: таблетки проходят через вращающийся перфорированный барабан, где очищаются от пыли.
Следующим этапом изготовления таблетированных лекарственных форм является их стандартизация: в отделе контроля качества лекарств предприятия-производителя проводятся определение подлинности, количественное определение и тестирование на распадаемость. При удовлетворительности таблеток по данным показателям осуществляется их расфасовка и упаковка. На этой стадии производства таблеток применяют автомат непрерывного формования.
Наиболее гигиеничной, удобной, гарантирующей таблетированным лекарственным формам защиту от вредных влияний атмосферного воздуха и загрязнения является контурная безъячейковая упаковка, стрип или блистер (укупоренные блистеры помещают в картонные коробки).
Расфасованные таблетки оформляют и маркируют в соответствии с требованиями нормативной документации.
Стоит отметить, что таблетки, как и другие лекарственные формы, несмотря на их положительные стороны и относительную простоту производства, имеют ряд недостатков:
- при хранении таблетки могут терять распадаемость и цементироваться или разрушаться;
- с таблетками в организм вводятся вещества, не имеющие терапевтической ценности, а иногда вызывающие некоторые побочные явления (например, тальк раздражает слизистую оболочку желудка);
- не все пациенты, особенно дети, могут свободно проглатывать таблетки
Однако, производство и применение таблетированных форм, по сравнению с другими твердыми лекарственными формами (гранулами, порошками и каплями), позволяют упростить и повысить точность дозирования лекарственных средств.
1.2. Формирование показателей качества
таблетированных лекарственных форм
Одним из основных условий промышленного производства таблетированных лекарственных форм является соответствие готовой продукции требованиям действующей нормативно-технической документации.
Поскольку таблетки в промышленных условиях получают методом прессования, они могут иметь разную форму, размеры и массу. В связи с этим определение качества таблетированных лекарственных форм начинается с оценки их внешнего вида (органолептических свойств), на которые влияют следующие факторы: условия прессования, адгезионные и когезионные свойства таблетируемой массы и ее влажность, гранулометрический состав, поверхность и точность пресс-инструмента, способ покрытия и др.
Наиболее распространенной является круглая форма. Она удобна для изготовления, упаковки и применения лекарственной формы. Иногда таблеткам для предотвращения подделок придают оригинальную форму - прямоугольную с округленными углами, с крестообразной насечкой и гравировкой.
Контроль формы таблеток проводят на основании осмотра невооруженным глазом. Таблетки должны иметь круглую или иную форму с плоскими или двояковыпуклыми поверхностями, цельными краями. Поверхность таблеток должна быть гладкой, однородной. На поверхности могут быть гравировка, надписи и обозначения, указанные в нормативной документации конкретного предприятия-изготовителя. Если диаметр таблеток составляет 9 мм и более, то на таблетках должна быть риска (насечка).
Лекарственные препараты в виде таблеток относятся к дозированным лекарственным формам. Точность дозирования зависит от многих факторов: дозирование будет точным, если в матрицу таблеточной машины будет поступать всегда строго определенное количество таблетируемой массы. Это зависит, прежде всего, от постоянства объема матричного гнезда и сыпучести (текучести) таблетируемой массы.
Известно, что сыпучесть порошков обычно определяется такими свойствами, как форма и размер частиц, распределение их по размеру. Сферические частицы обладают лучшей текучестью, чем игольчатые и пластинчатые. Сыпучестью не обладают мелкие порошки лекарственных веществ из-за высокой силы когезии частиц друг другу. Субстанции лекарственных средств часто являются полидисперсными, т.е. состоят из частиц различных размеров. При таблетировании они расслаиваются, что вызывает изменение массы таблеток. Из этого следует, что большая часть лекарственных веществ перед таблетированием требует предварительной подготовки, которая заключается в выравнивании формы и размеров частиц, увеличении размера мелких частиц до оптимальной величины. Для этой цели используют различные вспомогательные вещества и технологические приемы, например, зернение (гранулирование) материала. Однако практически невозможно добиться идеальной однородности таблетируемого материала по форме и размеру частиц. Это обстоятельство вызывает колебания в массе таблеток, которые строго нормируются.
Придаваемая таблеткам форма должна быть устойчивой в течение всего срока годности таблетированных лекарственных препаратов. Поэтому таблетки должны обладать достаточной прочностью, чтобы оставаться неповрежденными при механических воздействиях в процессе упаковки, транспортировки и хранения. Возникающие повреждения приводят к ухудшению внешнего вида таблеток и нарушению дозировки лекарственных веществ в них.
Для придания таблеткам прочности в таблетируемую массу вводят вспомогательные вещества, которые способствуют связыванию частиц. Важно, чтобы количество связывающих веществ было оптимальным: превышение их приводит к излишней твердости таблеток, а при недостатке не достигается требуемая прочность. В связи с этим обстоятельством возникает необходимость в контроле механической прочности таблетированных лекарственных форм посредством определения такого показателя качества, как прочность таблеток на истирание.
Как было отмечено выше, таблетки должны быть прочными, но в то же время должны распадаться в желудке или кишечнике при контакте с пищеварительными соками для высвобождения из лекарственной формы действующего вещества (таблетированные лекарственные формы должны распадаться в короткий промежуток времени с тем, чтобы обеспечить быстрое высвобождение лекарственного вещества, большую скорость его растворения и диффузии к поверхности всасывания).
Для достижения требуемой распадаемости в таблетируемую массу вводят разрыхляющие вспомогательные вещества. Однако распадаемость таблеток зависит также от количества связывающих вспомогательных веществ и величины давления прессования (превышение количества связывающих веществ, чрезмерное давление ухудшают распадаемость таблеток). Плохая распадаемость может быть причиной задержки или снижения терапевтического действия препарата, или его кумуляции в организме. Нераспадающиеся таблетки могут проходить желудочно-кишечный тракт, не оказывая терапевтического действия на организм. Поэтому тест на распадаемость является одной из основных характеристик качества таблеток.
Известно, что лекарственные вещества в таблетках в зависимости от условий кристаллизации (природа растворителя, скорость и температура кристаллизации, наличие примесей) образуют различные полиморфные модификации, отличающиеся формой и размером кристаллов. Образующиеся кристаллические формы лекарственных веществ обладают одинаковыми химическими свойствами, но различаются по стабильности, растворимости, температуре плавления и другим физическим свойствам. Различная растворимость полиморфных форм влияет на скорость всасывания лекарственных веществ. Это требует определения такого показателя качества таблеток, как растворимость, в определенной степени характеризующий биологическую доступность (для массовой оценки качества таблеток биологическая доступность на людях не определяется ввиду сложности и трудоемкости). Данный показатель отражает постоянство свойств таблетированной лекарственной формы от серии к серии и свидетельствует о соблюдении надлежащих условий производства.
Обладая определенными физико-химическими свойствами, вспомогательные вещества могут вступать в химические взаимодействия с действующими веществами или способствовать их деструкции, некоторые из них могут оказывать побочное действие на организм. Поэтому выбор вспомогательных веществ в каждом конкретном случае должен быть научно обоснован. Причем, используемые в производстве таблеток вспомогательные вещества должны быть разрешены к применению в медицинской практике.
Из большого перечня вспомогательных веществ, применяемых при производстве таблеток, определяется лишь содержание талька и аэросила, оказывающих раздражающее действие на слизистые оболочки желудочно-кишечного тракта. Содержание других вспомогательных веществ оценивают косвенно по показателю средней массы таблетки.
Для контроля точности дозирования таблеток вводится такой физический показатель, как средняя масса и отклонение в массе отдельных таблеток.
В ходе анализа таблетированных лекарственных форм для обеспечения правильной дозировки лекарственных средств устанавливается подлинность и определяется содержание каждого из действующих веществ. Однако усредненный показатель количественного определения не является объективным для лекарственных препаратов с низкой дозировкой действующего вещества. Высокая биологическая активность многих лекарственных веществ обусловливает применение их в чрезвычайно малых терапевтических дозах (0,005 г и менее). Даже незначительные отклонения от дозы могут привести к заметному изменению терапевтической эффективности.
В тех случаях, когда лекарственные вещества входят в состав таблетки в небольшой дозировке, используются наполнители (разбавители) для придания таблетке определенной массы. Причем, наполнители могут превышать количество действующего вещества в 100 и более раз. В таких случаях возникает опасность неравномерного распределения лекарственного вещества в таблеточной массе, что может привести к значительной вариации содержания действующего вещества в отдельных таблетках, хотя среднее его значение может оставаться в пределах нормативных требований. Вследствие этого таблетки, содержащие лекарственные вещества в количестве 0,05 г и менее, подвергаются дополнительному испытанию на однородность дозирования.
Помимо испытаний на подлинность и содержание действующих веществ, таблетированные лекарственные препараты подвергаются испытанию на чистоту. Как правило, в таблетках нормируют специфические примеси, образующиеся в процессе технологии таблеток или попадающие в лекарственные препараты из исходных фармацевтических субстанций.
Обязательно контролируется содержание высокотоксичных примесей. Количество таких примесей ограничивают пределами, не превышающими их содержание в исходных субстанциях. Лабильные лекарственные вещества могут подвергаться деструкции в процессе технологии изготовления таблеток на стадиях влажной грануляции, сушки и прессования. Для таких лекарственных препаратов допускается более высокое содержание специфических примесей, чем в исходных субстанциях. Однако, в любом случае количество допустимой примеси в таблетках не должно влиять на фармакологические свойства действующего вещества и оказывать неблагоприятное воздействие на организм.
В процессе производства, транспортировки и хранения таблетки могут подвергаться контаминации патогенными и непатогенными микроорганизмами. К бактериологическим показателям качества таблетированных лекарственных форм относятся обсемененность микроорганизмами, спорами и бактериями непатогенного характера с содержанием не более установленного количества.
Микробная контаминация снижает терапевтическую ценность лекарственных препаратов, а такие микроорганизмы, как кишечная палочка, золотистый стафилококк, сальмонелла, синегнойная палочка могут стать причиной возникновения кишечных и других инфекций. Наличие вышеуказанных микроорганизмов недопустимо, обнаружение их в лекарственных препаратах свидетельствует о грубом нарушении санитарно-гигиенических правил.
Лекарственные препараты в форме таблеток имеют длительный срок хранения – 2 года и более. В процессе хранения действующие и вспомогательные вещества таблеток могут разрушаться под воздействием факторов окружающей среды. Во избежание этого подбирается оптимальная упаковка, обеспечивающая качество таблеток при хранении.
Важное значение имеет также маркировка лекарственной формы, так как она включает информацию о предприятии-производителе, название препарата и содержание действующего вещества, способ применения, регистрационный номер, номер серии, срок годности, штриховой код и дополнительные обозначения, защищающие лекарственные препараты от фальсификации. Отсюда следует, что в комплекс испытаний качества таблетированных лекарственных препаратов обязательно включается контроль упаковки и маркировки нормативным требованиям.
1.3. Нормативные документы, регламентирующие
производство и контроль качества таблеток
Контроль производства и управления технологическим процессом по производству таблетированных лекарственных форм осуществляется в соответствии с техническими инструкциями, регламентами и спецификациями производства, утвержденными предприятием-изготовителем и составленными в соответствии с Федеральным законом Российской Федерации от 12 апреля 2010 г. № 61 «Об обращении лекарственных средств» и Приказом Министерства промышленности и торговли Российской Федерации от 14 июня 2013 г. № 916 «Об утверждении Правил организации производства и контроля качества лекарственных средств», а также Приказом Министерства промышленности и торговли Российской Федерации от 18 декабря 2015 г. № 4148 «О внесении изменений в приказ Министерства промышленности и торговли Российской Федерации от 14 июня 2013 г. № 916 «Об утверждении Правил организации производства и контроля качества лекарственных средств».
Федеральный закон от 12.04.2010 г. № 61-ФЗ «Об обращении лекарственных средств» регулирует любые отношения, возникающие в связи с обращением лекарственных средств, т.е. их разработкой, доклиническими и клиническими исследованиями, экспертизой, государственной регистрацией, стандартизацией и контролем качества, производством, изготовлением, хранением, перевозкой, ввозом на территорию России, вывозом из России, рекламой, отпуском, реализацией, передачей, применением, уничтожением. Настоящий Федеральный закон устанавливает приоритет государственного регулирования безопасности, качества и эффективности лекарственных средств при их обращении.
Приказ Министерства промышленности и торговли Российской Федерации от 14 июня 2013 г. № 916 «Об утверждении Правил организации производства и контроля качества лекарственных средств» утверждает соответствующие Правила, распространяющиеся на все виды лекарственных средств и устанавливающие общие требования к организации их производства и контроля качества.
В Российской Федерации установлены две категории нормативной документации: Государственные стандарты качества и Фармакопейные статьи предприятия.
К Государственным стандартам качества относятся следующие категории нормативных документов: Общие фармакопейные статьи и Фармакопейные статьи.
Общие фармакопейные статьи – это Государственные стандарты качества лекарственных средств, содержащие основные требования к лекарственным формам, а так же описание стандартных методов контроля качества лекарственных средств. Они включают перечень нормируемых показателей и методы испытания для конкретных лекарственных форм, описание химических, физических, физико-химических, биологических, биохимических, микробиологических методов анализа лекарственных средств, а также требования к используемым титрованным растворам, реактивам, индикаторам.
Фармакопейные статьи – это нормативно-технические документы, устанавливающие требования к качеству лекарственных средств, их упаковке, условиям и сроку хранения, методам контроля качества.
С 1 января 2016 г. Приказом Министерства здравоохранения Российской Федерации от 29 октября 2015 г. № 771 «Об утверждении общих фармакопейных статей и фармакопейных статей» введена в действие ОФС.1.4.1.0015.15 Таблетки (взамен ст. ГФ XI, дата введения в действие: 1 01.12.2018 г.; статус; Действующая статья), согласно которой для любых таблетированных лекарственных форм предусмотрены несколько критериев и этапов контроля качества.
Оценку внешнего вида таблеток осуществляют при осмотре невооруженным глазом 20 таблеток. Приводят описание формы и цвета таблеток.
Поверхность таблетки должна быть гладкой, однородной, если не обосновано иное в ФС.
На таблетках не должно быть следующих дефектов размера, цвета, покрытия, шрифта надписи, разделительной риски:
- выступы (поверхность в выступах, прилипших частиц порошка);
- углубление (лунки, выкрошенные части таблеток);
- грязь или пыль на таблетках;
- мраморность (неравномерный цвет, локальное изменение цвета);
- сколы (отслоение или сколы таблетки, уменьшение толщины);
- слипание (слипание двух таблеток вместе или их соединение разрушенными поверхностями);
- крошение;
- деформация (нарушение округлости формы);
- царапины и другие дефекты покрытия (поверхность покрытия неравномерна, различной толщины, смещена по отношению к ядру).
На поверхности таблетки могут быть нанесены штрихи, риски для деления, надписи и другие обозначения. Для таблеток диаметром 9 мм и более рекомендуется наличие риски.
Определение однородности массы таблеток проводят в соответствии с требованиями ОФС.1.4.2.0009.15 Однородность массы дозированных лекарственных форм. Испытание проводят на 20 единицах лекарственной формы, отобранных случайным образом: определяют среднюю массу взвешиванием 20 единиц таблеток. Взвешивают каждую единицу в отдельности c точностью до 0,001 г и рассчитывают среднюю массу.
Лекарственную форму считают выдержавшей испытание, если не более двух индивидуальных масс отклоняются от средней массы на величину, превышающую допустимое отклонение, указанное в ОФС.1.4.2.0009.15. При этом ни одна индивидуальная масса не должна отклоняться от средней массы на величину, в 2 раза превышающую значение, указанное в таблице.
Прочность на истирание определяют в соответствии с требованиями ОФС.1.4.2.0004.15 Прочность таблеток на истирание в рамках контроля технологического процесса производства таблеток. Для этого применяют специальный прибор, который состоит из барабана диаметром 200 мм со съемной крышкой, по внутреннему периметру которого расположены 12 лопастей под углом 20° к касательной барабана, часового механизма и электрооборудования, обеспечивающего вращение барабана со скоростью 20 оборотов в минуту.
10 таблеток, обеспыленных и взвешенных с точностью до 0,001 г, помещают в барабан, привинчивают крышку и включают устройство на 5 минут, что соответствует 100 оборотам барабана. По истечении установленного времени таблетки обеспыливают и определяют их массу с точностью до 0,001 г.
Прочность на истирание должна быть не менее 97 %, причем форма таблеток не должна изменяться в процессе испытания.
Таблетки без оболочки должны выдерживать испытание на распадаемость в соответствии с ОФС.1.4.2.0013.15 Распадаемость таблеток и капсул на лабораторном идентификаторе процесса распадаемости. Он состоит из сборной корзинки, сосуда для жидкости вместимостью 1 л, термостатического устройства, поддерживающего температуру жидкости в пределах (37±2)°С, и электромеханического устройства, сообщающего корзинке возвратно-поступательное движение в вертикальной плоскости при частоте 28-32 цикла в 1 минуту.
Для проведения испытания отбирают 18 образцов исследуемой лекарственной формы и проводят определение в течение времени, описанного в статье для данной лекарственной формы. При отсутствии других указаний таблетки должны распадаться в течение не более 15 минут.
Образец считается полностью распавшимся, когда нет никакого остатка или остаток представляет собой мягкую массу, которая разрушается при легком прикосновении стеклянной палочки. Наличие такого остатка должно быть оговорено в фармакопейной статье или нормативной документации.
Все образны должны полностью распадаться. Если 1 или 2 образца не распались, повторяют испытание на оставшихся 12 образцах. Не менее 16 из 18 образцов должны полностью распасться.
Для кишечнорастворимых таблеток (покрытых оболочкой), если не указано иначе в фармакопейной статье или нормативной документации, проводят испытание на распадаемость со следующими изменениями: испытание проводят в два этапа. В качестве жидкой среды на первом этапе используют хлористоводородной кислоты раствор 0,1 М. Время устойчивости таблеток в кислой среде не должно быть менее 1 часа и более 3 часов. Таблетки не должны распадаться и обнаруживать признаки растрескивания и размягчения. На втором этапе кислоту заменяют фосфатным буферным раствором с рН 6,8. Если нет других указаний в фармакопейной статье или нормативной документации, то в буферном растворе таблетки должны распадаться в течение 1 часа.
Таблетки шипучие должны распадаться или растворяться в течение 5 минут. Одну таблетку помещают в стакан, содержащий 200 мл воды при температуре от 15 до 25 °С, при этом начинают выделяться пузырьки газа. Таблетка считается распавшейся или растворившейся, если после прекращения выделения пузырьков газа вокруг нее или ее фрагментов, таблетка или растворилась, или диспергировалась в воде, и агломераты частиц отсутствуют. Тест повторяют на 5 других таблетках.
Определение распадаемости таблеток также проводят в рамках контроля технологического процесса производства таблеток.
Испытание на растворение проводят для подтверждения соответствующего высвобождения действующего вещества или веществ в таблетированных лекарственных формах одним из способов, описанных в ОФС.1.4.2.0014.15 Растворение для твердых дозированных лекарственных форм.
Для оценки растворения используют прибор «Вращающаяся корзинка», основной рабочей частью которого является цилиндрической формы сетчатая корзинка с отверстиями диаметром 0,25 мм. В нее помещают испытуемый образец. В качестве среды растворения используют воду или другие растворители, указанные в частных ФС.
При испытании корзинка вращается в среде растворения (объем среды растворения до 1 л) со скоростью 50-200 оборотов в минуту. В процессе определения с помощью термостата поддерживают температуру (37±1)°С.
Через время, указанное в частных статьях, или через 45 минут (если нет указаний) отбирают пробу раствора, фильтруют. В фильтрате проводят количественное определение действующего вещества соответствующим аналитическим методом, приведенным в частной статье. Используемый аналитический метод должен быть достаточно точен, однако он может быть иным, чем метод, предусмотренный для количественного определения действующего вещества в лекарственной форме.
Для каждой серии лекарственной формы рассчитывают количество вещества перешедшего в раствор (в процентах от содержания в таблетке или капсуле, которое принимают за 100%), как среднее для 5 таблеток.
Если другие требования не предусмотрены в частных статьях, серия считается удовлетворительной при растворении в воде за 45 минут при режиме перемешивания 100 оборотов в минуту в среднем не менее 75 % действующего вещества от содержания в лекарственной форме.
Для кишечнорастворимых таблеток, если нет других указаний в фармакопейной статье или нормативной документации, проводят испытание, подтверждающее отсроченное высвобождение необходимого количества действующего вещества в соответствии с ОФС Растворение для твердых дозированных лекарственных форм.
В том случае, если в фармакопейной статье или нормативной документации предусмотрено определение растворения, испытание на распадаемость таблеток не является обязательным.
Испытание дисперсности проводят только для диспергируемых таблеток. Две таблетки помещают в колбу, содержащую 100 мл воды, и перемешивают до полного диспергирования. Должна образоваться однородная суспензия, проходящая через сито с номинальным размером отверстий 710 мкм.
Потерю в массе при высушивании проводят в тех случаях, когда содержание воды может влиять на свойства действующего вещества, стабильность лекарственного препарата и т.д. Определение проводят в соответствии с ОФС.1.2.1.0010.15 Потеря в массе при высушивании: точную навеску испытуемой лекарственной формы, указанную в фармакопейной статье или нормативной документации, помещают в предварительно высушенный до постоянной массы и взвешенный в условиях проведения испытания бюкс.
Пробу сушат с открытой крышкой бюкса до постоянной массы или в течение времени, указанного в фармакопейной статье или нормативной документации, одним из следующих способов:
- способ 1: пробу высушивают в течение 2 часов в сушильном шкафу в пределах температурного интервала, указанного в фармакопейной статье или нормативной документации. Затем открытый бюкс вместе с крышкой помещают в эксикатор для охлаждения на 50 минут, после чего закрывают крышкой и взвешивают. Последующие взвешивания проводят после каждого часа дальнейшего высушивания до достижения постоянной массы. При отсутствии других указаний пробу сушат до постоянной массы при температуре от 100 до 105ºС.
- способ 2: высушивание проводят в эксикаторе над фосфора (V) оксидом при атмосферном давлении и комнатной температуре (возможно использование иных условий, указанных в фармакопейной статье или нормативной документации).
При использовании в технологическом процессе производства таблеток органических растворителей должен быть предусмотрен контроль их остаточного содержания в соответствии с требованиями ОФС.1.1.0008.15 Остаточные органические растворители. Норму содержания органического растворителя приводят в мкг/таблетку, исходя из предельно допустимой суточной дозы растворителя и из максимальной суточной дозы препарата.
Определение содержания остаточных органических растворителей может быть осуществлено различными валидированными методиками, описанными в частных статьях.
Определение вспомогательных веществ в таблетированных лекарственных формах нормируется в фармакопейных статьях или нормативной документации.
Определение проводят по следующей методике: около 1 г (точная навеска) порошка растертых таблеток обрабатывают в сосуде 200 мл теплой воды, жидкость отфильтровывают через беззольный фильтр и сосуд тщательно ополаскивают водой. Остаток на фильтре несколько раз промывают теплой водой (по 10 мл) до отсутствия видимого остатка после выпаривания капли промывной воды на часовом стекле. Фильтр с остатком высушивают, сжигают, прокаливают и взвешивают с точностью до 0,0001 г. Допустимые значения приведены в частных статьях.
Испытание однородности дозирования проводят согласно требований ОФС.1.4.2.0008.15 Однородность дозирования для таблеток без оболочки с содержанием 0,05 г и менее лекарственного вещества и для таблеток, покрытых оболочкой, с содержанием лекарственного вещества 0,01 г и менее. От серии, подлежащей испытанию, отбирают пробу таблеток в количестве 30 штук.
В каждой из 10 таблеток определяют содержание лекарственного вещества. Содержание лекарственного вещества в одной таблетке может отклоняться не более чем на ±15% от среднего содержания, и ни в одной таблетке не должно превышать ±25 %.
Если из 10 испытанных таблеток 2 таблетки имеют отклонения содержания лекарственного вещества более, чем на ±15 % от среднего, определяют содержание лекарственного вещества в каждой из оставшихся 20 таблеток. Отклонение в содержании лекарственного вещества ни в одной из 20 таблеток не должно превышать более чем ±15 % от среднего.
Для определения подлинности и количественного анализа берут навеску растертых таблеток (не менее 20 штук). Если измельчение таблетки может повлечь за собой разложение действующего вещества или затруднено получение однородно измельченного порошка, проводят испытание на целой таблетке или таблетках. В этом случае рекомендуется использовать не менее 10 таблеток. Конкретные методики анализа и интервалы допустимых значений приведены в частных фармакопейных статьях.
Фармакопейные статьи предприятия – это стандарты качества лекарственных средств под торговым названием. Они содержат перечень методов и показателей контроля качества лекарственных средств производства конкретного предприятия, где учитывается конкретная технология данного предприятия, прошедшая экспертизу и регистрацию в установленном порядке в соответствии с ГФ, при этом показатели качества, должны быть не ниже требований, перечисленных в ГФ.
Организацией-держателем подлинников ОФС, ФС и ФСП является Министерство здравоохранения Российской Федерации. Держателем подлинников Фармакопейных статей предприятия является также соответствующее предприятие-производитель или организация-разработчик.
Для оценки качества лекарственных любых средств применяется два термина: «Удовлетворяет» (годная продукция) или «Не удовлетворяет» (брак) требованиям ГФ, действующих Приказов и инструкций, Фармакопейных статей предприятия, спецификаций и др.
Неудовлетворительность таблеток устанавливают по следующим параметрам:
- неудовлетворительность по внешнему виду (неправильная форма таблеток с выщербленными краями, поверхность неоднородная);
- неудовлетворительность по прочности;
- неудовлетворительность по массе отдельных таблеток;
- неудовлетворительность по распадаемости;
- неудовлетворительность по тесту «Растворение»;
- неудовлетворительность по подлинности;
- неудовлетворительность по массе отдельных ингредиентов;
- неудовлетворительность по однородности дозирования;
- неудовлетворительность по количеству вспомогательных веществ;
- неудовлетворительность по отдельным показателям, указанным в частных фармакопейных статьях.
Лекарственные препараты в форме таблеток имеют достаточно длительный срок хранения – 2 года и более. В процессе хранения действующие и вспомогательные вещества таблеток могут разрушаться под воздействием факторов окружающей среды. Во избежание этого подбирается оптимальная упаковка, обеспечивающая качество таблеток при хранении. Наиболее широко применяется контурная ячейковая упаковка из полимерного материала. С целью исключения механического воздействия на таблетки контурные упаковки помещают в картонные коробки.
Для сохранения свойств таблеток на протяжении всего срока годности они должны выпускаться в упаковке, предохраняющей их от внешних воздействий и обеспечивающей стабильность в течение установленного периода времени. Хранить таблетки необходимо в сухом месте.
Большое значение имеет также маркировка лекарственной формы, так как она включает информацию о предприятии-производителе, название препарата и содержание действующего вещества, способ применения, регистрационный номер, номер серии, срок годности, штриховой код и другие дополнительные обозначения, защищающие лекарственные препараты от фальсификации.
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
1. Что такое твердые лекарственные формы? таблетки?
2. Какие показатели определяют качество таблетированных лекарственных форм?
3. Перечислите нормативные документы, регламентирующие качество таблеток.
4. Как определяется однородность массы таблеток?
5. Какой должна быть прочность таблеток? Как её определяют?
6. Какие требования предъявляет ГФ к распадаемости таблеток без оболочки? Как определяется распадаемость таблеток?
7. Какой показатель качества, нормируемый ГФ, характеризует таблетки с биофармацевтической позиции? Как его определяют?
8. Каковы способы определения однородности дозирования таблеток?
9. Каковы особенности определения подлинности действующих веществ в таблетках. Как осуществляется выбор метода и приемов анализа?
10. Каковы особенности количественного определения действующих веществ в таблетках. Как осуществляется выбор метода и приемов анализа?
ПРАКТИЧЕСКАЯ ЧАСТЬ.
КОНТРОЛЬ КАЧЕСТВА ТАБЛЕТОК АЦЕТИЛСАЛИЦИЛОВОЙ КИСЛОТЫ ОТЕЧЕСТВЕННОГО ПРОИЗВОДСТВА
2.1. Стандартизация таблеток ацетилсалициловой кислоты.
Отечественные и зарубежные производители
Ацетилсалициловая кислота – лекарственное средство, оказывающее анальгезирующее (обезболивающее), жаропонижающее, противово-спалительное и антиагрегантное действие.
Механизм действия и профиль безопасности рассматриваемого лекарственного средства хорошо изучены, эффективность клинически апробирована, в связи с чем данный препарат входит в список важнейших лекарственных средств Всемирной организации здравоохранения, а также в перечень жизненно необходимых и важнейших лекарственных средств Российской Федерации.
Народная медицина издавна рекомендовала кору молодых ветвей белой ивы как жаропонижающее средство, например, для приготовления отвара. Получила кора признание и у медиков под названием Salicis cortex.
В стабильной форме, пригодной для очистки, салициловая кислота была впервые выделена из ивовой коры итальянским химиком Р. Пириа в 1838 г. Впервые была синтезирована Ш.-Ф. Жераром в 1853 г.
В 1859 г. профессор химии Г. Кольбе открыл химическую структуру салициловой кислоты, а в 1875 г. для лечения ревматизма и в качестве жаропонижающего средства был применен салицилат натрия.
10 августа 1897 г. Ф. Хоффман, работавший в лабораториях фирмы Bayer AG, впервые получил образцы ацетилсалициловой кислоты в форме, возможной для медицинского применения, пытаясь найти лекарство для своего отца, страдавшего ревматизмом. Однако наряду с Хоффманом изобретателем аспирина также называют А. Айхенгрюна. Сырьем для получения ацетилсалициловой кислоты служила кора дерева ивы.
После долгих споров по вопросу наименования полученного лекарственного средства за основу было решено использовать латинское наименование растения, из которого берлинский ученый К.-Я. Ловиг впервые выделил салициловую кислоту, – Spiraea ulmaria. К четырем первым буквам «spir» приставили «a», чтобы подчеркнуть особую роль реакции ацетилирования в получении лекарственного препарата, а справа – для благозвучия и в соответствии со сложившейся традицией – окончание «in». Получилось простое в произношении и легко запоминающееся название «Aspirin» («Аспирин»). Фирма Bayer зарегистрировала новое лекарство под этой торговой маркой.
Уже в 1899 г. первая партия нового лекарства появилась в продаже. Изначально был известен лишь жаропонижающий эффект аспирина, позднее выяснились также его болеутоляющие и противовоспалительные свойства. В первые годы он продавался как порошок, а с 1904 г. – в форме таблеток.
В 1983 г. в медицинском журнале New England Journal of Medicine появилась публикация исследования, в котором было доказано новое важное свойство препарата – при его использовании во время нестабильной стенокардии уменьшается риск возникновения инфаркта миокарда.
В 1971 г. фармаколог Дж. Вейн продемонстрировал, что аспирин подавляет синтез простагландинов и тромбоксанов. За это открытие в 1982 году ему, а также С. Бергстрему и Б. Самуэльсону была присуждена Нобелевская премия по медицине.
В настоящее время ацетилсалициловая кислота является самым широко используемым фармакологическим препаратом во всем мире. По данным Всемирной организации здравоохранения, это одно из самых безопасных обезболивающих и противовоспалительных средств, а спектр показаний к применению лекарственного средства все еще расширяется.
В России традиционное бытовое название ацетилсалициловой кислоты – аспирин. На основании традиционности термина фирме Bayer было отказано в регистрации бренда «Аспирин» в России.
В современной медицине используется несколько лекарственных форм ацетилсалициловой кислоты – таблетки (шипучие таблетки) и порошок. Таблетированные лекарственные формы являются наиболее востребованными – ежегодно потребляется более 80 миллиардов таблеток аспирина.
Показаниями к применению являются: повышение температуры тела, лихорадка, болевой синдром (головная, зубная, мышечная и др. боли), острые воспалительные процессы, остеохондроз, люмбаго, профилактика развития инфаркта миокарда или ишемического инсульта, стенокардия нестабильного характера, генетическая предрасположенность к тромбоэмболиям и тромбофлебитам, пороки сердца, инфаркт легкого, тромбоэмболия легочной артерии.
Дозировка определяется в зависимости от показаний. Максимальная суточная доза для взрослого составляет 3 г. Детям назначается лишь в случае неэффективности других жаропонижающих средств. Отпускается в аптеках без рецепта врача.
По данным Российского фармацевтического портала Rusanalogi.ru (2023 г.) таблетки ацетилсалициловой кислоты производят на следующих отечественных химико-фармацевтических предприятиях и фабриках:
- ЗАО «БАЙЕР»;
- ЗАО «Алтайвитамины»;
- ООО «Анжеро-Судженский химико-фармацевтический завод»;
- ЗАО «Аптеки 36,6»;
- ООО «АСФАРМА»;
- ЗАО «Верофарм»;
- ОАО «Дальхимфарм»;
- ОАО «Ирбитский химико-фармацевтический завод»;
- ОАО «Марбиофарм»;
- ЗАО «Медисорб»;
- ЗАО «Московская фармацевтическая фабрика»;
- ОАО «Тюменский химико-фармацевтический завод»;
- ОАО «Озон Фармацевтика»;
- ЗАО «Производственная фармацевтическая компания Обновление»;
- ОАО «Татхимфармпрепараты»
- ОАО «Уралбиофарм»;
- ОАО «Усолье-Сибирский химфармкомбинат»;
- ОАО «Фармстандарт»;
- ОАО «Фармстандарт-Лексредства»;
- ЗАО «ФП Оболенское» (Приложение 1).
Стоит отметить, в настоящее время существует огромное количество лекарственных препаратов – структурных аналогов ацетилсалициловой кислоты, в том числе зарубежного производства: Алка-Зельтцер, Алька-Прим, Анопирин, Апо-Аса, АСК-Кардио, Аскопирин, Аспекард, Аспетер, Аспиватрин, Аспизол, Аспикард, Аспикор, Аспилайт, Аспинат, Аспитрин, Аспомай, Аспро, Аспровит, АСС-Ратиофарм, Ацекардол, Ацентерин, Ацесал, Ацетилин, Ацетилсалицилбене, Ацилпирин, Ацсбирин, Буфферан, Буфферин, КардиАСК, Кардиопирин, Колфарит, Микристин, Некстрим Актив, Новандол, Нью-Аспер, Плидол, Полокард, Сановаск, Таспир, Тромбо АСС, Тромбогард, Тромбокард, Тромбопол, Уолш-Алгин, Упсарин УПСА, Эйч-Эл-Пейн, Элкапин.
Стандартизация таблеток ацетилсалициловой кислоты в РФ осуществляется в соответствии с Государственными стандартами качества РФ и Фармакопейными статьями предприятия:
1) Название препарата на русском языке: Ацетилсалициловая кислота.
2) Название препарата на латинском языке: Acidum acetylsalicylicum.
3) Международное непатентованное название на русском языке: Ацетилсалициловая кислота.
4) Международное непатентованное название на латинском языке: Acidum acetylsalicylicum.
5) Регистрационный номер: П № 013664/01.
6) Торговое название: Ацетилсалициловая кислота, Аспирин.
7) Лекарственная форма: таблетки.
8) Фармакологическая группа: нестероидный противовоспалительный препарат. Салициловая кислота и ее производные. Код АТХ: N02BA01.
9) Состав: одна таблетка содержит:
- ацетилсалициловой кислоты 100, 200, 250, 300 или 500 мг;
- вспомогательных веществ (крахмал картофельный, кислота лимонная, тальк, кислота стеариновая, кремния диоксид коллоидный безводный) достаточное количество.
10) Описание: таблетки белого цвета, с плоской поверхностью, риской или фаской.
11) Распадаемость: таблетки без оболочки должны распадаться в течение 15 минут; таблетки, покрытые оболочкой, должны распадаться в течение 30 минут; время устойчивости кишечнорастворимых таблеток (покрытых оболочкой) не должно быть менее 1 часа и более 3 часов.
12) Растворение: количество растворенного за 45 минут в воде лекарственного вещества должно быть не менее 75%.
13) Средняя масса таблеток: допускаются следующие отклонения в массе отдельных таблеток:
- для таблеток массой 0,08 г и менее ± 10 %;
- массой более 0,08 г и менее 0,25 г ± 7,5 %;
- массой 0,25 г и более ± 5 %.
Только две таблетки могут иметь отклонения от средней массы, превышающие указанные пределы, но не более чем вдвое.
14) Прочность на истирание: должна быть не менее 97%.
15) Определение вспомогательных веществ: талька должно быть не более 3%.
16) Определение подлинности и содержания лекарственного вещества: методы контроля качества ацетилсалициловой кислоты определяются физико-химической природой лекарственного средства. Реакции подлинности и методы количественного анализа нормированы соответствующими ОФС и ФС. Допустимые отклонения указаны в Фармакопейных статьях предприятия. В случае отсутствия таких указаний допустимые отклонения составляют:
- при дозировке лекарственного вещества до 0,001 г ± 15 %;
- при дозировке лекарственного вещества от 0,001 до 0,01 г ± 10 %;
- при дозировке лекарственного вещества от 0,01 до 0,1 г ± 7,5 %;
- при дозировке лекарственного вещества от 0,1 и более ± 5 %.
17) Определение родственных примесей: содержание свободной салициловой кислоты должно быть не более 0,25% от средней массы таблетки.
18) Испытание однородности дозирования: проводят для таблеток без оболочки с содержанием 0,05 г и менее лекарственного вещества и для таблеток, прокрытых оболочкой, с содержанием лекарственного вещества 0,01 г и менее.
Содержание лекарственного вещества в одной таблетке может отклоняться не более чем на ± 15% от среднего и ни в одной таблетке не должно превышать ± 25%. Если из 10 испытанных таблеток 2 таблетки имеют отклонения более чем на ± 15% от среднего, дополнительно определяют содержание лекарственного вещества 20 таблеток. Отклонение в содержании лекарственного вещества ни в одной из них не должно превышать более чем ± 15% от среднего.
19) Микробиологическая чистота: категория 3А (не более 1000 в 1 г).
20) Условия хранения: в защищенном от света и влаги месте, при температуре не выше 25°С. Хранить в недоступном для детей месте.
21) Срок годности: 4 года. Не использовать после окончания срока годности.
19) Условия отпуска из аптек: без рецепта.
2.2. Физико-химическая природа и
методы химического контроля качества
таблеток ацетилсалициловой кислоты
Качество выпускаемых в промышленных условиях таблетированных лекарственных форм ацетилсалициловой кислоты определяется показателями, описанными в теоретической части пособия. Методы контроля качества подразделяются на следующие группы: органолептические, физические, химические и биологические.
Контроль качества таблеток ацетилсалициловой кислоты проводят согласно требований ОФС.1.4.1.0015.15 Таблетки, ФС Ацетилсалициловая кислота таблетки (проект) (введена взамен ФС 42-3254-95 Ацетилсалициловая кислота, таблетки), ФС.2.1.0006.15 Ацетилсалициловая кислота, Аспирин (введена взамен ГФ XII, ч. 1, ФС 42-0220-07 Ацетилсалициловая кислота; взамен ФС 42-0040-00 Ацетилсалициловая кислота), а также частным фармакопейным статьям по следующим показателям:
- упаковка;
- маркировка;
- описание (внешний вид);
- определение подлинности;
- определение количественного содержания лекарственного средства.
Таблетки ацетилсалициловой кислоты содержат действующее вещество, по химической природе представляющее собой уксусный эфир салициловой кислоты:
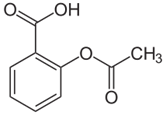
Международное название по номенклатуре ИЮПАК: 2-ацетилоксибензойная кислота.
Брутто-формула: C₉H₈O₄.
Молекулярная масса: 180,16 г/моль.
Температура плавления: 133-1380С.
Константа диссоциации: pKa = 3,7.
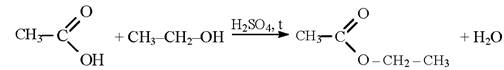
Ацетилсалициловая кислота не должна иметь запаха уксусной кислоты. Синтез ацетилсалициловой кислоты в промышленных условиях производится путем нагревания салициловой кислоты с уксусным ангидридом:
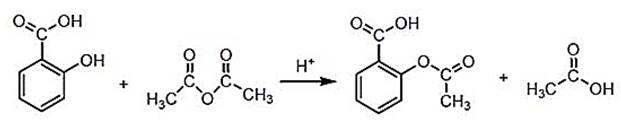
Для производства лекарственных средств субстанция ацетилсалициловой кислоты подвергается очистке.
По внешнему виду ацетилсалициловая кислота представляет собой кристаллический порошок белого цвета или бесцветные кристаллы без запаха или со слабым запахом, слабокислого вкуса.
Ацетилсалициловая кислота мало растворима в воде, легко растворима в 95 % спирте, растворима в эфире. Хорошо растворима в растворах щелочей, мало в воде (1:300), этаноле (1:7), хлороформе (1:17), диэтиловом эфире (1:20).
Согласно требований ФС.2.1.0006.15 Ацетилсалициловая кислота, Аспирин, для установления подлинности применяют следующие методы:
1) Определение ИК-спектра. Инфракрасный спектр ацетилсалициловой кислоты, снятый в диске с калия бромидом, в области частот от 4000 до 400 см-1, по положению полос поглощения должен соответствовать рисунку спектра стандартного образца ацетилсалициловой кислоты.
2) Определение УФ-спектра. Ультрафиолетовый спектр поглощения 0,007 % раствора ацетилсалициловой кислоты в хлороформе в области от 260 до 350 нм дожен иметь максимум поглощения при 278 нм.
Ультрафиолетовый спектр поглощения 0,001% раствора ацетилсалициловой кислоты в 0,1 М растворе серной кислоты в области от 220 до 350 нм должен иметь максимумы поглощения при 228 нм и 276 нм и минимум поглощения при 257 нм.
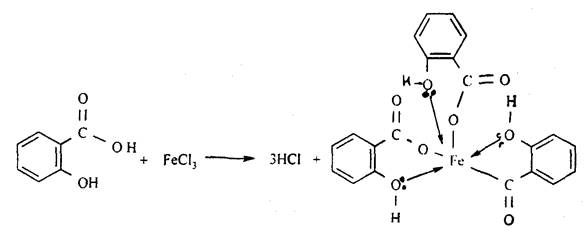
При отсутствии необходимого оборудования для проведения физико-химических методов исследования подлинности лекарственного средства и учитывая физико-химическую природу ацетилсалициловой кислоты (сложный эфир), для идентификации используют следующую качественную реакцию: навеску кипятят в течение не менее 3 минут с раствором натрия гидроксида, охлаждают, нейтрализуют серной кислотой разведенной 16%. В результате образуется белый кристаллический осадок (салициловая кислота), а раствор должен приобрести запах уксусной кислоты:
Раствор сливают в другую пробирку, куда прибавляют равные объемы спирта и концентрированной серной кислоты. Должен появиться запах уксусно-этилового эфира:
К осадку прибавляют несколько капель раствора железа (III) хлорида. Должно появиться фиолетовое окрашивание:
Для идентификации также может быть использована альтернативная реакция образования ауринового красителя: к навеске ацетилсалициловой кислоты прибавляют несколько капель концентрированной серной кислоты, перемешивают, прибавляют 0,1 мл воды. Должен появиться запах уксусной кислоты (гидролиз; химизм см. выше). Прибавляют 1-2 капли формалина; должно появиться розовое окрашивание:
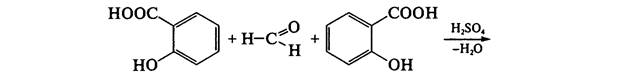
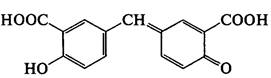
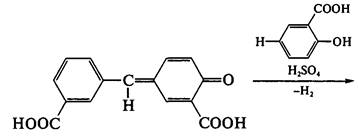
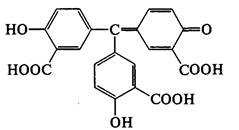
В отличие от салициловой кислоты чистая ацетилсалициловая кислота не дает реакции с железа (III) хлоридом FeCl3, так как не имеет свободного фенольного гидроксила.
В ацетилсалициловой кислоте при ее неправильном хранении, образуются примеси: 4-гидроксибензойная кислота, 4-гидроксибензен-1, 3-дикарбоксильная кислота (4-гидроксиизофталевая кислота), 2-[[2-(ацетокси)-бензоил]-окси]-бензойная кислота. Определение родственных примесей проводят методом ВЭЖХ.
Определение количественного содержания ацетилсалициловой кислоты проводят методом алкалиметрии. Точную навеску растворяют в 10 мл нейтрализованного по фенолфталеину и охлажденного до температуры 8-10 0С спирта 96% и титруют 0,1 М раствором натрия гидроксида до появления розового окрашивания (индикатор – 1% раствор фенолфталеина):
Параллельно проводят контрольный опыт.
Хранят таблетки ацетилсалициловой кислоты в хорошо укупоренной упаковке в сухом месте, так как ацетилсалициловая кислота как сложный эфир, легко гидролизуется: во влажном воздухе она распадается на уксусную и салициловую кислоты.
2.3. Контроль качества таблеток ацетилсалициловой кислоты
различных отечественных производителей
Практическое задание
Практическое задание: осуществить контроль качества таблеток ацетилсалициловой кислоты различных отечественных производителей в соответствии с рассмотренными требованиями действующей нормативной документации РФ и Фармакопейными статьями предприятий-производителей.
Объекты контроля качества: представлены в таблице 1.
Таблица 1. Объекты контроля качества - таблетки
ацетилсалициловой кислоты 0,5 г различных отечественных производителей
|
№ п/п |
Испытуемые образцы |
Произво-дитель |
Декларация о соответствии |
Нормативные документы, регламентирующие контроль качества |
|
|
Государственные стандарты качества |
ФСП |
||||
|
1 |
Ацетил-салициловая кислота МС таблетки 0,5 г 10 шт. |
ЗАО «МЕДИ-СОРБ» |
№ РОСС RU.ФМ05. Д23225 от 25.07.2015 г. |
ОФС.1.4.1.0015.15 Таблетки; ФС Ацетил-салициловая кислота таблетки (проект), ФС.2.1.0006.15 Ацетил-салициловая кислота, Аспирин |
Р N002019/ 01-200809 изм. № 1 |
|
2 |
Ацетил-салициловая кислота таблетки 0,5 г 10 шт. |
ЗАО «ПФК Обновление» |
№ РОСС RU.ФМ10. Д19403 от 07.02.2015 г. |
ЛС-001533-210111 |
|
|
3 |
Ацетил-салициловая кислота таблетки 0,5 г 10 шт. |
ОАО «Фарм-стандарт-Лексредства» |
№ РОСС RU.ФМ05. Д70224 от 18.02.2015 г. |
Р N003846/ 01-100609 изм. № 1,2 |
|
До извлечения таблеток проведите контроль качества на соответствие упаковки и маркировки лекарственных препаратов требованиям ФС (ФСП). Оценку внешнего вида таблеток произведите на чистой, ровной, белой поверхности (таблица 2).
Таблица 2. Требования к упаковке, маркировке и описанию таблеток
ацетилсалициловой кислоты 0,5 г различных отечественных производителей
|
№ п/п |
Испытуемые образцы |
Произво-дитель |
Упаковка |
Маркировка |
Описание |
|
1 |
Ацетил-салициловая кислота МС таблетки 0,5 г 10 шт. |
ЗАО «МЕДИ-СОРБ» |
По 10 таблеток в ячейковой контурной упаковке. По 2 упаковки в пачке картонной с инструкцией по применению |
Должна быть нанесена четкими, разборчивыми, легко заметными и несмываемыми буквами. Маркировка вторичной упаковки должна включать торговое наименование, МНН, название производителя и его место-нахождение (юридический адрес), название лекарственной формы и содержание активного вещества (перечень вспомогательных веществ указан в инструкции по применению), условия и особенности хранения и отпуска, номер серии, срок годности, штрих-код и товарный знак. Маркировка первичной упаковки должна включать торговое наименование, МНН, название организации-производителя, его товарный знак и юридический адрес, название лекарственной формы, номер серии, срок годности |
Таблетки белого цвета, плоско-цилиндри-ческой формы с фаской и риской без запаха Таблетки белого цвета, плоско-цилиндрической формы с фаской и риской без запаха |
|
2 |
Ацетил-салициловая кислота таблетки 0,5 г 10 шт. |
ЗАО «ПФК Обнов-ление» |
По 10 таблеток в безъячейко-вой контурной упаковке |
||
|
3 |
Ацетил-салициловая кислота таблетки 0,5 г 10 шт. |
ОАО «Фарм-стандарт-Лексредства» |
По 10 таблеток в ячейковой контурной упаковке. По 2 упаковки в пачке картонной с инструкцией по применению |
Для определения подлинности используйте химические методы экспресс-анализа (таблица 3).
Таблица 3. Определение подлинности таблеток
ацетилсалициловой кислоты 0,5 г различных отечественных производителей
|
№ п/п |
Испытуемые образцы |
Произво-дитель |
Определение подлинности |
Наблюдаемый эффект |
|
1 |
Ацетил-салициловая кислота МС таблетки 0,5 г 10 шт. |
ЗАО «МЕДИ-СОРБ» |
1) 0,5 г порошка растертых таблеток кипятят в течение 3 минут с 5 мл раствора натрия гидроксида. Осаждают, фильтруют. Фильтрат подкисляют серной кислотой. Раствор сливают в другую пробирку и добавляют к нему 2 мл спирта и 2 мл концентрированной серной кислоты. К осадку добавляют 1-2 капли раствора хлорида окисного железа (химизм см. выше).
2) 0,2 г порошка растертых таблеток помещают в фарфоровую чашку, прибавляют 0,5 мл концентрированной серной кислоты, перемешивают. Затем прибавляют 1-2 капли формалина. |
1) После кипячения выделяется белый кристаллический осадок. Раствор приобретает запах уксусно-этилового эфира. С раствором хлорида окисного железа появляется фиолетовое окрашивание.
2) После добавления раствора серной кислоты ощущается запах кислоты уксусной. При добавлении формалина появляется розовое окрашивание. |
|
2 |
Ацетил-салициловая кислота таблетки 0,5 г 10 шт. |
ЗАО «ПФК Обновление» |
||
|
3 |
Ацетил-салициловая кислота таблетки 0,5 г 10 шт. |
ОАО «Фарм-стандарт-Лексредства» |
Для определения количественного содержания действующего вещества используйте экспресс-метод титрования (таблица 4).
Таблица 4.Определение количественного содержания действующего вещества
в таблетках ацетилсалициловой кислоты 0,5 г различных отечественных производителей
|
№ п/п |
Испытуемые образцы |
Произво-дитель |
Определение количествен-ного содержания |
Предварительные расчеты |
|
1 |
Ацетил-салициловая кислота МС таблетки 0,5 г 10 шт. |
ЗАО «МЕДИ-СОРБ» |
0,05 г порошка растертых таблеток взбалтывают с 10 мл нейтрализо-ванного по фенол-фталеину 95% спирта этилового. Жидкость охлаждают и титруют 0,1 н. раствором натрия гидроксида от бесцветного до розового окрашивания (индикатор – 1% раствор фенол-фталеина)
|
Титр по определяемому веществу:
где Т – титр по определяемому веществу, г/мл; Мэкв – молярная масса эквивалента определяемого вещества, г/моль.
где М – молярная масса определяемого вещества, г/моль; Z – число эквивалентности.
|
|
2 |
Ацетил-салициловая кислота таблетки 0,5 г 10 шт. |
ЗАО «ПФК Обнов-ление» |
||
|
3 |
Ацетил-салициловая кислота таблетки 0,5 г 10 шт. |
ОАО «Фарм-стандарт-Лексредст-ва» |
Исходя из полученных результатов титрования, рассчитывают содержание действующего вещества в одной таблетке по формуле:
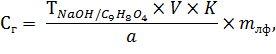
где Сг – содержание действующего вещества на вес одной таблетки, г;
V – объем титранта, мл;
К – поправочный коэффициент титранта;
а – навеска анализируемой лекарственной формы, г;
mлф – масса таблетки, г.
Рассчитайте теоретический расход титранта, при необходимости предложите разведение.
По результатам титрования расчеты укажите в виде таблицы 5.
Согласно ОФС.1.4.1.0015.15 Таблетки, допустимые отклонения содержания ацетилсалициловой кислоты в таблетках 0,5 г составляют 0,475-0,525 г, в таблетках 0,1 г – 0,095-0,105 г.
Таблица 5. Расчет количественного содержания действующего вещества
в таблетках ацетилсалициловой кислоты 0,5 г различных отечественных производителей
(необходимо заполнить полученными в результате титрования данными)
|
№ п/п |
Испытуемые образцы |
Произво-дитель |
Средний объем титранта, израсходо-ванный на титрование навески |
Расчет содержания лекарственного вещества в таблетке |
|
1 |
Ацетил-салициловая кислота МС таблетки 0,5 г 10 шт.
|
ЗАО «МЕДИ-СОРБ» |
|
|
|
2 |
Ацетил-салициловая кислота таблетки 0,5 г 10 шт.
|
ЗАО «ПФК Обнов-ление» |
|
|
|
3 |
Ацетил-салициловая кислота таблетки 0,5 г 10 шт.
|
ОАО «Фарм-стандарт-Лексредст-ва» |
|
|
Сделайте заключение о качестве лекарственной формы: рассмотренные в ходе исследования таблетированные лекарственные формы кислоты ацетилсалициловой различных отечественных производителей удовлетворяют/не удовлетворяют требованиям контроля качества по показателям «Упаковка», «Маркировка», «Описание», «Определение подлинности», «Определение количественного содержания лекарственного вещества в таблетках».
Результаты исследования оформите в виде протокола.
ПРОТОКОЛ АНАЛИЗА
№ ______ от ______________________
|
Наименование лекарственного препарата |
|
|||
|
МНН |
|
|||
|
Форма выпуска |
|
|||
|
НД |
|
|||
|
Химическое название |
|
|||
|
Химическая формула |
|
|||
|
М.м. |
|
|||
|
Упаковка: |
||||
|
Требование: |
Результат испытания: |
|||
|
Заключение: |
Соответствует требованиям НД/ не соответствует требованиям НД |
|||
|
Маркировка: |
||||
|
Требование: |
Результат испытания: |
|||
|
Заключение: |
Соответствует требованиям НД/ не соответствует требованиям НД |
|||
|
Описание: |
||||
|
Требование:
|
Результат испытания: |
|||
|
Заключение: |
Соответствует требованиям НД/ не соответствует требованиям НД |
|||
|
Определение подлинности: |
||||
|
Компонент 1 |
||||
|
Химическое название |
|
|||
|
Химическая формула |
|
|||
|
М.м. |
|
|||
|
Компонент 2 |
||||
|
Химическое название |
|
|||
|
Химическая формула |
|
|||
|
М.м. |
|
|||
|
Определение подлинности: |
||||
|
Компонет 1 |
||||
|
Реакция 1. |
||||
|
Методика, уравнение химической реакции:
|
Результат испытания: |
|||
|
Реакция 2. |
||||
|
Методика, уравнение химической реакции:
|
Результат испытания: |
|||
|
Компонент 2 |
||||
|
Реакция 1 |
||||
|
Методика, уравнение химической реакции:
|
Результат испытания: |
|||
|
Реакция 2 |
||||
|
Методика, уравнение химической реакции:
|
Результат испытания: |
|||
|
Заключение: |
Соответствует требованиям НД/ не соответствует требованиям НД |
|||
|
Количественное определение: |
||||
|
Компонент 1 |
||||
|
Методика, уравнения химических реакций:
|
Расчеты, результат испытания: |
|||
|
Компонент 2 |
||||
|
Методика, уравнения химических реакций:
|
Расчеты, результат испытания: |
|||
|
Условия и сроки хранения: |
||||
|
|
||||
|
Заключение: лекарственное средство удовлетворяет/ не удовлетворяет требованиям НД. |
||||
|
Анализ провел: _____________________________________ |
Дата: __________________ |
|||
|
Начальник ОКК (преподаватель):________________________________ |
Подпись:____________________ |
СИТУАЦИОННЫЕ ЗАДАЧИ
1. Составьте алгоритм контроля качества и укажите химические методы анализа:
1.1. Таблеток парацетамола 0,5 г.
1.2. Таблеток изониазида 0,1 г.
1.3. Таблеток димедрола 0,05 г .
1.4. Таблеток нитроксолина 0,05 г, покрытых оболочкой.
1.5. Таблеток бутадиона 0,05 г, покрытых оболочкой.
2. Какой объем 0,05 н. раствора натрия нитрита пойдет на титрование навески порошка растертых таблеток сульфалена 0,3000 г?
3. Рассчитайте навеску порошка растертых таблеток фенилбутазона (бутадиона) по 0,15 г, которую следует взять для анализа, чтобы на ее титрование израсходовалось 7,50 мл 0,1 н. раствора натрия гидроксида. Средняя масса таблеток 0,260 г.
4. Рассчитайте содержание фенобарбитала, если на титрование навески 0,1476 г порошка растертых таблеток израсходовано 5,14 мл 0,1 н. раствора натрия гидроксида в смеси метанола и бензола (К = 0,9975). Средняя масса таблеток 0,310 г.
5. Рассчитайте содержание анальгина в таблетках, если навеску порошка растертых таблеток массой 0,5048 г довели до метки спиртоводной смесью в мерной колбе вместимостью 50,0 мл, отфильтровали. На титрование 25,0 мл фильтрата пошло 11,8 мл 0,05 н. раствора йода (К = 0,99). Масса 20 таблеток – 12,0840 г. Соответствует ли содержание анальгина требованиям ФС.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. Федеральный закон от 12 апреля 2010 г. № 61-ФЗ «Об обращении лекарственных средств» // Справочно-правовая система «Консультант Плюс». Режим доступа: http://www.consultant.ru.
2. Приказ Министерства промышленности и торговли Российской Федерации от 14 июня 2013 г. № 916 «Об утверждении Правил организации производства и контроля качества лекарственных средств» // Справочно-правовая система «Консультант Плюс». Режим доступа: http://www.consultant.ru.
3. ОФС.1.4.2.0009.15 Однородность массы дозированных лекарственных форм // Информационно-правовой портал ГАРАНТ.РУ. Режим доступа: http://www.regmed.ru.
4. ОФС.1.4.2.0004.15 Прочность таблеток на истирание // Информационно-правовой портал ГАРАНТ.РУ. Режим доступа: http://www.regmed.ru.
5. ОФС.1.4.2.0013.15 Распадаемость таблеток // Информационно-правовой портал ГАРАНТ.РУ. Режим доступа: http://www.regmed.ru.
6. ОФС.1.4.2.0014.15 Растворение для твердых дозированных лекарственных форм // Информационно-правовой портал ГАРАНТ.РУ. Режим доступа: http://www.regmed.ru.
7. ОФС.1.4.1.0015.15 Таблетки // Информационно-правовой портал ГАРАНТ.РУ. Режим доступа: http://www.regmed.ru.
8. ФС.2.1.0006.15 Ацетилсалициловая кислота // Pharmacopoeia.ru. Режим доступа: http://pharmacopoeia.ru.
9. Арзамасцев А.П. Фармакопейный анализ. – М.: Медицина, 2001.
10. Беликов В.Г. Фармацевтическая химия. В 2 частях. Часть 1. – М.: Высшая школа, 2003.
11. Глущенко Н.Н. Фармацевтическая химия / Н.Н. Глущенко, Т.В. Плетенева, В.А. Попков. Под ред. Т.В. Плетеневой. – М.: Академия, 2004.
12. Ермилова Е.В. Анализ лекарственных средств: учебное пособие / Ермилова Е.В., Кадырова Т.В., Дудко В.В. – Томск: СибГМУ, 2010.
13. Сливкин А.И. Функциональный анализ органических лекарственных веществ / А.И. Сливкин, В.П. Садчикова. – Воронеж: ВГУ, 2007.
14. Тыжигирова В.В. Показатели качества и особенности анализа таблеток. – Иркутск, 2012.
15. Ацетилсалициловая кислота. Российские аналоги препарата // Российские аналоги импортных препаратов. Режим доступа: http://www.rusanalogi.ru.
16. Препараты ацетилсалициловой кислоты // Ацетилсалициловая кислота. Режим доступа: http://acetylsalicylicacid.ru.
17. Технологический процесс производства таблеток // Технологический процесс производства таблеток. Электронный учебник. Режим доступа: http://ztl.nuph.edu.
18. Упаковка и хранение таблеток // Информационный сайт для фармацевтов Рharmspravka.ru. Режим доступа: http://www.pharmspravka.ru.
19. Фармакопейный анализ органических лекарственных веществ. Методические рекомендации к лабораторно-практическим занятиям. – Нижний Новгород: изд-во Нижегородской государственной медицинской академии, 2009 // Сайт Нижегородской государственной медицинской академии. Режим доступа: http://www.mma.ru.
Приложение 1
Основные производители
таблеток ацетилсалициловой кислоты в России
Ацетилсалициловая кислота
Форма выпуска: таблетки.
Состав: ацетилсалициловая кислота (500 мг), вспомогательные вещества.
Производитель: ЗАО «ПФК Обновление» (Россия).
Ацетилсалициловая кислота МС
Форма выпуска: таблетки.
Состав: ацетилсалициловая кислота (500 мг), вспомогательные вещества.
Производитель: ЗАО «МЕДИСОРБ» (Россия).
Ацетилсалициловая кислота – УБФ

Форма выпуска: таблетки.
Состав: ацетилсалициловая кислота (500 мг), вспомогательные вещества.
Производитель: ОАО «Уралбиофарм» (Россия).
Ацетилсалициловая кислота
Форма выпуска: таблетки.
Состав: ацетилсалициловая кислота (500 мг), вспомогательные вещества.
Производитель: ОАО «Марбиофарм» (Россия).
Ацетилсалициловая кислота

Форма выпуска: таблетки.
Состав: ацетилсалициловая кислота (500 мг), вспомогательные вещества.
Производитель: ОАО «Уралбиофарм» (Россия).
Ацетилсалициловая кислота
Форма выпуска: таблетки.
Состав: ацетилсалициловая кислота (500 мг), вспомогательные вещества.
Производитель: ОАО «Фармстандарт» (Россия).
Ацетилсалициловая кислота

Форма выпуска: таблетки.
Состав: ацетилсалициловая кислота (500 мг), вспомогательные вещества.
Производитель: ОАО «Фармстандарт» (Россия).
Ацетилсалициловая кислота

Форма выпуска: таблетки.
Состав: ацетилсалициловая кислота (500 мг), вспомогательные вещества.
Производитель: ОАО «Ирбитский ХФЗ» (Россия).
Ацетилсалициловая кислота

Форма выпуска: таблетки.
Состав: ацетилсалициловая кислота (500 мг), вспомогательные вещества.
Производитель: ОАО «Озон Фармацевтика» (Россия).
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.