
Уравнение состояния идеального газа. Молярная газовая постоянная
Напомним еще раз, что газ
любой массы характеризуется тремя макроскопическими параметрами: давлением,
объемом и температурой. Как мы уже убедились, эти параметры связаны между
собой. В одном из прошлых уроков мы вывели формулу, связывающую давление,
концентрацию и температуру: ![]()
Концентрация
определяется как число молекул в единице объема: ![]()
Подставим это в наше
уравнение: ![]()
В свою очередь, количество молекул равно произведению количества вещества и числа Авогадро:
![]()
Преобразуем основное уравнение в соответствии с этой формулой и перенесем объем в левую часть:
![]()
Наконец, количество вещества,
как мы знаем, — это отношение массы к молярной массе: ![]()
![]()
Таким образом, в правой части одними из множителей являются постоянная Больцмана и постоянная Авогадро. Произведение этих двух постоянных называется универсальной газовой постоянной:
![]()
Итак, произведение давления и
объема равно произведению температуры, универсальной газовой постоянной и отношения
массы к молярной массе: ![]()
Это уравнение называется уравнением состояния идеального газа.
В этом уравнении единственная величина, которая зависит от рода газа — это молярная масса. Тем не менее, это уравнение точно описывает состояние только достаточно разряженных газов, которые можно считать идеальными. Поэтому данное уравнение и называется уравнение состояния идеального газа. Для реальных газов в это уравнение добавляются некоторые числовые корректировки в соответствии со специфическими свойствами реального газа. Однако, эти корректировки не вносят принципиальные изменения в данное уравнение, поэтому в большинстве случаев уравнение состояния идеального газа достаточно точно описывает реальные процессы.
Другое называние уравнения
состояния идеального газа — это уравнение Менделеева — Клапейрона. Дело в том, что Клапейрон проводил свои опыты
для постоянной массы газа. В 1834 году, он пришел к очень важному выводу:
отношение произведения давления и объема к температуре есть величина постоянная
для постоянной массы газа: ![]()
То есть, какой бы макропараметр газа постоянной массы ни изменился, два других параметра изменятся таким образом, чтобы указанное соотношение осталось постоянным.
Спустя целых сорок лет, то
есть в 1874 году, Менделеев вновь рассмотрит уравнение Клапейрона и преобразует
его для произвольного количества вещества. В первую очередь, Менделеев
рассмотрел это уравнение для количества вещества, равного одному молю. Он
пришел к выводу, что в этом случае, отношение произведения давления и объема к
температуре равно произведению постоянной Больцмана и постоянной Авогадро. Это,
как мы уже сказали, универсальная газовая постоянная. ![]()
А чтобы получить уравнение для
произвольного количества вещества, нужно правую часть домножить на количество
вещества: ![]()
Количество же вещества можно
представить как отношение массы к молярной массе: ![]()
Таким образом, Менделеев, можно сказать, доработал уравнение Клапейрона. Поэтому, уравнение состояния идеального газа получило название «уравнение Менделеева-Клапейрона».
Уравнение состояния идеального газа позволяет дать ответы на три основных группы вопросов.
Во-первых, если известны два любых макропараметра, то можно определить третий. В одном из прошлых уроков мы убедились, что именно этот факт используют в газовых термометрах. Баллон с рабочим газом помещают в жидкость, после чего к баллону подключается манометр. Объем газа, конечно же, равен объему баллона, а давление измеряется манометром. Следовательно, можно определить температуру.
Во-вторых, с помощью уравнения идеального газа, можно рассмотреть различные процессы, происходящие в системе при тех или иных условиях. Например, как при постоянной температуре будет меняться объем с увеличением давления. Об этом мы подробно поговорим в дальнейшем.
В-третьих, с помощью уравнения идеального газа можно определить, как меняется состояние системы при теплообмене, каким образом система может совершить работу.
Примеры решения задач.
Задача1. Как изменится температура идеального газа, если его давление увеличилось в 3 раза, а объем уменьшился в 2 раза?
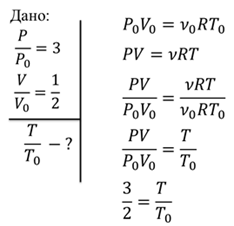
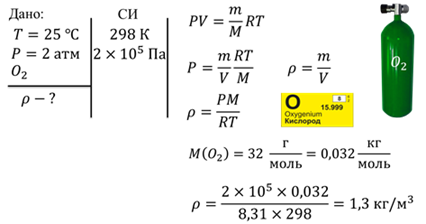
Задача 2. Кислород находится в баллоне при температуре 25 ℃. Давление в баллоне составляет 2 атм. Найдите плотность кислорода при таких условиях.

Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.