
Дата _________________
Урок 17. Фосфор
Цель: развитие и систематизация знаний о строении атомов элементов неметаллов и свойствах простых веществ неметаллов на примере фосфора.
Задачи:
ü формировать представления о положении фосфора в периодической системе химических элементов и электронном строении его атома;
ü формировать знания о физических и химических свойствах фосфора;
ü формировать представления об основных природных соединениях и применении простого вещества фосфор;
ü совершенствовать умения определять степени окисления элемента в химическом соединении и составлять уравнения окислительно-восстановительных реакций на основе метода электронного баланса.
Тип: усвоение новых знаний.
Учебно-методическое обеспечение: учебное пособие; рабочая тетрадь; периодическая система химических элементов Д. И. Менделеева; образцы фосфора для демонстрации 8.
Ход урока
1. Организационный момент
Учитель приветствует учащихся, проверяет их готовность к уроку.
2. Проверка домашнего задания
У доски проверяется выполнение заданий 3, 4, 7 (§ 26) и задания 4 (§ 39).
Остальные учащиеся выполняют тест на с. 78 рабочей тетради.
3. Целеполагание
Учитель предлагает учащимся вспомнить повесть А. Конан Дойла «Собака Баскервилей».
— В конце повести выяснилось, что собаку намазывали фосфором и она светилась в темноте, вызывая страх у окружающих. Возможно ли это?
4. Актуализация знаний и умений учащихся
Учитель предлагает учащимся предположить, какие свойства характерны для фосфора.
5. Изучение нового материала и первичный контроль
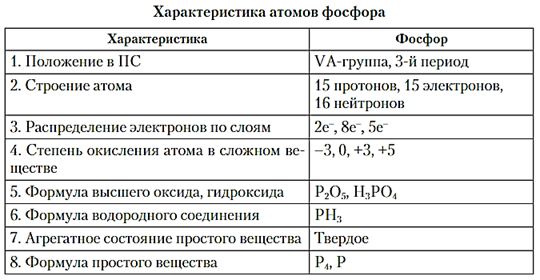
1. Пользуясь § 27 учебного пособия, учащиеся составляют в рабочих тетрадях таблицу «Характеристика атомов фосфора». Таблица обязательно дублируется на мультимедийной презентации.
2. При помощи учебного пособия учащиеся выписывают аллотропные модификации фосфора. Записываются характеристики белого и красного фосфора, разница физических свойств аллотропных модификаций фосфора.
3. Учитель предлагает учащимся выполнить задания.
1) Запишите уравнения реакций, характеризующие химические свойства фосфора по следующей схеме:
а) окислительные свойства (с водородом и металлами). При обычных условиях реагирует только литий, остальные — при нагревании. Объясните, почему такие степени окисления у фосфора.
![]()
б) восстановительные (с неметаллами с большей электроотрицательностью). Объясните, почему такие степени окисления у азота и фосфора.
![]()
2) Составьте уравнения реакции:
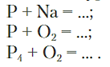
6. Физкультминутка
7. Обобщение и систематизация изученного
Учащимся предлагается выполнить тест.
1) Укажите возможную степень окисления фосфора:
а) –4; б) +5; в) +1.
2) Белый, красный и черный фосфор отличаются между собой:
а) физическими свойствами;
б) качественным составом;
в) типом кристаллической решетки.
3) Фосфор так же, как и азот, входит в состав:
а) нитратов; б) воздуха; в) всех живых организмов.
4) Простое вещество фосфор:
а) хорошо растворяется в воде;
б) легко распадается на ионы;
в) не вступает в реакцию с водородом.
5) Окислительные свойства фосфора проявляются во взаимодействии:
а) с О2; б) Cl2; в) Са.
6) Сумма коэффициентов перед формулами в уравнении химической реакции горения фосфора равна:
а) 9; б) 11; в) 8.
7) Вещество, формула которого РH3, называется:
а) аммиак; б) оксид фосфора; в) фосфин.
8) В производстве спичек применяется:
а) белый фосфор; б) красный фосфор; в) черный фосфор.
9) Фосфор, взаимодействуя с металлами, образует:
а) фосфаты; б) фосфиды; в) фосфины.
10) При взаимодействии с металлами фосфор проявляет:
а) восстановительные свойства;
б) окислительные свойства;
в) кислотные свойства.
8. Информация о домашнем задании
§ 27, задания 3, 7, 8.
9. Подведение итогов
10. Рефлексия
— Вернемся к отрывку из повести А. Конан Дойла «Собака Баскервилей». Почему описанный сюжет невозможен в реальной жизни?
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.