
Урок химии 9 класс. Тема урока: Характеристика щелочных металлов и их соединений.
Цель урока: Образовательная: дать общую характеристику щелочных металлов по положению в периодической таблице и строению атомов; рассмотреть их нахождение в природе, физические и химические свойства, важнейшие соединения и применение щелочных металлов;
Развивающая: овладение учащимися умений анализировать, выделять главное, сравнивать, систематизировать, объяснять, обобщать;
Воспитательная: воспитание интереса к предмету, личности социально активной, способной работать в коллективе.
Содержание урока:
1. Организационный момент.
Вступительное слово учителя.Приветствие, выявление эмоционального состояния учащихся, положительный настрой учащихся на урок
На прошедшем уроке, мы закончили изучать главу «Общие свойства металлов», и вы знаете, что металлы имеют большое значение в практической жизни современного человека. Вы уже изучили: положение металлов в периодической таблице, особенности строения атомов, изучили общие физические и химические свойства, а также общие способы получения металлов, познакомились с понятием «сплавы». Мы продолжаем изучать металлы, но теперь более подробно рассмотрим некоторых представителей среди металлов.
2. Актуализация знаний учащихся.
-Как вы думаете, какие металлы вы будете изучать, прежде всего?металлы IА группы – щелочные металлы. Находятся в первой группе, самые активные среди металлов.
-Как вы думаете, какие вопросы необходимо рассмотреть, изучая щелочные металлы
Положение щелочных металлов в периодической таблице и строение их атомов.
Нахождение в природе.
Получение.
Физические свойства.
Химические свойства.
Применение.
-вам известны некоторые сведения о щелочных металлах. Назовите эти сведения.металлы IА группы называются щелочными металлами, потому что при взаимодействии с водой, образуют растворимые в воде основания- щелочи. У щелочных металлов один валентный электрон на внешнем энергетическом уровне, который они легко отдают в химических реакциях, приобретая степень окисления +1. Валентность –I.
-Перечислите щелочные металлы.Литий, натрий, калий, рубидий, цезий, франций.
-Как происходит изменение радиуса атома у щелочных металлов. Как это скажется на активности металла? Сверху вниз размер радиуса увеличивается, и металлические свойства усиливаются.
-Необходимо записать электронные формулы атомов щелочных металлов, чтобы отобразить их электронную структуру.
|
Химический знак |
Размещение электронов по энергетическим уровням |
Электронная формула |
|
Na |
+11 Na 2e, 8e, 1e |
1s2 2s22p6 3s1
|
|
K |
+19 K 2e, 8e, 8e, 1e |
1s2 2s22p6 3s232p63d04s2 |
3. Изложение нового материала.
-перейдём к следующему вопросу нашего плана урока. Нахождение щелочных металлов природе.
Важнейшие природные соединения натрия и калия.
|
Название минерала |
Химическая формула |
Важнейшие месторождения |
|
Хлорид натрия |
NaCl |
Соляные озера Эльтон и Баскунчак, город Саликамск |
|
Сульфат натрия (мирабилит, глауберова соль) |
Na2SO4∙10H2O |
Кара-Богаз-Гол, Большое Соленое озеро |
|
Сильвинит |
NaCl∙KCl |
Соликамск |
|
Карналлит |
KCl∙MgCl2∙6H2O |
Соликамск, Штасфурт |
-демонстрирует классу образцы щелочных металлов, обращает внимание на условия их хранения (под слоем керосина). Учащиеся характеризуют физические свойства металлов.
Физические свойства: щелочные металлы серебристо- белого цвета с незначительными оттенками, легкие, мягкие, легкоплавкие. Их твердость и температура плавления закономерно снижаются от лития к цезию.
Демонстрационный опыт: учитель отрезает ножом кусочек натрия: блестящий срез быстро тускнеет на свету. почему происходит потускнение блестящего среза? Щелочные металлы – сильные восстановители, легко окисляются.
Необходимо записать уравнение химической реакции, отображающее данное свойство металлов.
Далее учитель совместно с учащимися рассматривает химические свойства щелочных металлов.
![]() Ученик:
Ученик:
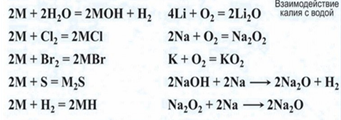
Данные реакции записываются в молекулярном виде и как окислительно -восстановительные процессы.
-рассмотрим применение щелочных металлов.
Натрий применяют в качестве восстановителя, например в цветной металлургии, в качестве теплоносителя в ядерных реакциях. Так же используется в качестве катализатора при синтезе некоторых органических веществ (получение синтетического каучука).
Щелочные металлы, особенно цезий, способны превращается в положительно заряженные ионы даже под действием света. Это свойство используют в фотоэлементах – приборах, превращающих энергию света в электрическую, и для изготовления автоматически действующих аппаратов. При освещении с поверхности цезия отрываются электроны, цепь замыкается, и аппарат автоматически начинает действовать.
Рассмотрите, пожалуйста, следующую схему (Работа учащихся со схемой «Применение соединений щелочных металлов». Самостоятельная работа с текстом стр 54-57.
Закрепление полученных знаний и умений.
Работа по заданиям:
1. Химический элемент, атомная масса которого 23, а число нейтронов в ядре равна 12, в периодической системе находится: а) в 3-м периоде, IБ группе; б) в 4-м периоде, IIIА группе, в) в 4 –м периоде, VIIБ группе; г) в 3-м периоде, IА группе;
2. Составьте уравнения реакций с кислородом: а) лития; б) натрия. Расставьте степени окисления элементов, покажите стрелкой переход электронов. Назовите продукты реакций.
3. Допишите уравнения реакций. а)Li + H2O→ … б)Na + H2O→… в)К + Н2О→…
4. Почему все щелочные металлы являются сильными восстановителями?
5. Назовите области применения щелочных металлов и их соединений.
4. Домашнее задание. § 11, упр.1б
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.