
Вода. Растворы
Повторение (ответить на вопросы):
1) Что такое химическая связь?
2) Перечислите виды химической связи.
3) Какой тип связи в бромиде натрия? кислороде? сероводороде? Ответ поясните.
4) Перечислите агрегатные состояния вещества. Какими основными свойствами обладают они обладают?
5) Что такое чистое вещество? Смесь? Приведите примеры.
6) Что такое дисперсные системы? Из чего они состоят?
7) Как классифицируют дисперсные системы?
8) К какой дисперсной системе относится зубная паста? Молоко? Дезодорант?
Изучение темы хотелось бы начать словами антрополога и натуралиста Лорена Айзли о воде: «Она есть повсюду; она соприкасается с прошлым и готовит будущее; она струится под полюсами и присутствует на больших высотах. Если есть что-то поистине загадочное на этой планете, так это вода»
Вода занимает особое положение среди других веществ. Вода распространена в природе повсеместно и встречается во всех трёх агрегатных состояниях. В твёрдом виде она покрывает ледяным покровом вершины гор и полярные страны. В жидком виде она заполняет впадины земной коры, покрывая поверхность земли океанами, морями, реками, озёрами. В газообразном состоянии (пар) вода содержится в составе атмосферы и влияет на изменение погоды. Вода входит в состав клеток и тканей любого животного и растения. Например, тело медузы состоит из воды на 99,9% , тело взрослого человека - на 60-80%. Помидоры, морковь содержат 90% воды. Вода распределена на планете неравномерно. Основную часть воды содержат океаны, на суше содержится небольшая часть воды. И только очень малая часть всего влагозапаса (0,014%) доступна для людей. Есть много районов на Земле, где воды катастрофически не хватает, в других местах – она потеряла свои ценные качества и стала непригодной из-за неразумной деятельности человека. Воду необходимо беречь и рационально использовать, ведь она применяется в различных областях: в быту, сельском хозяйстве, медицине, промышленности, энергетике.
Вода – самый распространённый растворитель. В ней растворяются и твердые вещества, и жидкости и газы. Например: Газированная вода – раствор углекислого газа в воде; Столовый уксус – раствор уксусной кислоты в воде. Нет таких веществ, которые, хотя бы в малой мере, не растворялись в воде. В воде в незначительной степени растворяются даже золото, серебро, железо, стекло. Ученые подсчитали, что, например, когда мы выпиваем стакан горячего чая, вместе с ним поглощаем примерно 0,0001 г растворенного стекла. Из-за способности воды растворять другие вещества ее никогда нельзя назвать абсолютно чистой. Понятие «чистая» вода условно.
Растворы. Классификация.
При растворении веществ в воде и в других растворителях образуются растворы. Что же представляют собой растворы?
Растворы – гомогенные (однородные) системы переменного состава, которые содержат два или несколько компонентов.
Раствор образуется за счёт взаимодействия между веществом и растворителем.
Раствор = вещество + растворитель
Растворы играют ключевую роль в природе, науке и технике. Растворы бывают:
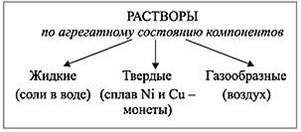
Наиболее распространены жидкие растворы. Они состоят из растворителя (жидкости) и растворенных веществ (газообразных, жидких, твердых):
|
Жидкие растворы |
||
|
Жидкость + газ
|
жидкость + жидкость |
жидкость + твердое вещество |
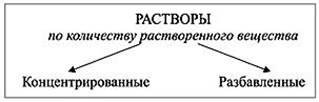
Если в определённом объёме раствора содержится мало растворенного вещества, то такой раствор называют разбавленным, если много – концентрированным.
Демонстрация: определите, в каком стакане разбавленный, а в каком концентрированный раствор медного купороса.
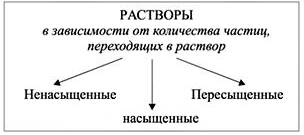
Ненасыщенный – раствор, содержащий меньше вещества, чем в насыщенном. Например, при внесении первых порций растворяемого вещества.
Насыщенный раствор – это раствор, в котором приданной температуре вещество больше не растворяется. Например, если растворять в воде небольшими порциями поваренную соль, наступит такой момент, когда кристаллы вещества перестанут растворяться. То есть раствор «насытился» хлоридом натрия.
Пересыщенный – раствор, содержащий больше вещества, чем в насыщенном. Пересыщенные растворы очень неустойчивы, избыток вещества выпадает в осадок.
Растворимость веществ
Содержание вещества в растворе может служить мерой его растворимости. Мы знаем, что одни вещества хорошо растворяются в воде, другие – плохо. Свойство вещества растворяться в воде или в другом растворителе называется растворимостью.
По растворимости в воде все вещества делятся на три группы:
|
1)Р – растворимые (более 10 г в 100 г воды). 2)М – малорастворимые (0,01–10 г в 100 г воды). 3)Н – нерастворимые вещества (меньше 0,01 г в 100 г воды), |
Растворимость веществ зависит:
1) от природы растворителя и вещества: издавна существует правило: подобное растворяется в подобном, т.е. вещества с ионной или ковалентной полярной связью лучше растворимы в полярных растворителях (вода) и плохо растворимы в неполярных (органические вещества).
2 )температуры: для большинства веществ характерно увеличение растворимости при нагревании. Например, все знают, что сахар лучше растворяется в горячей воде, чем в холодной. Для газов – растворимость увеличивается при понижении температуры.
3 )давления (для газов): с повышением давления растворимость газов в жидкостях увеличивается, а с понижением уменьшается.
Растворение веществ. Теории растворов
Вся практическая деятельность человека с самой глубокой древности связана с использованием воды и водных растворов. Разнообразными растворами пользовались при изготовлении строительных материалов, красок, стекла, керамики. Глиняные изделия, неразгаданные рецепты цветной глазури, покрывающие стены подземных гробниц фараонов, искусство бальзамирования, достигшее в Древнем Египте замечательного развития, – всё это опять же растворы, причём достаточно сложные по составу и весьма умело приготовленные тогда, первыми естествоиспытателями.
Чтобы получился раствор, должен пройти процесс растворения.
Растворение – это сложный физико-химический процесс. В настоящее время известны две основные теории растворов: физическая и химическая.
Суть физической теории (Я.Вант-Гофф, В.Оствальд, С.Аррениус): процесс растворения является результатом диффузии, то есть проникновения растворённого вещества в промежутки между молекулами воды, то есть физическое явление.
Суть химической теории (Д.Менделеев, И.Каблуков): растворение является результатом химического взаимодействия растворенного вещества с молекулами воды (гидратация), то есть химическое явление. При этом образуются соединения – гидраты. Они имеют различную прочность. Наиболее прочные – кристаллогидраты, например, СuSO4·5H2O медный купорос. Процесс сопровождается выделением или поглощением теплоты, изменением цвета.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.