
Жалпы білім беретін Бұлдырты орта мектебі
Қысқа мерзімді жоспар
|
Сыныбы, пәні: 9ә , химия 28.02.2017 |
Пән мұғалімі: Бегайдарова Г.Б. химия пәнінің мұғалімі БалпейсоваГ.А. ағылшын тілі пәнінің мұғалімі |
|
|||||||||||||||||||||||||||||||||||||||||
|
Сабақтың тақырыбы |
Металдар мен бейметалдар және олардың қосылыстарының арасындағы генетикалық байланыс. |
|
|||||||||||||||||||||||||||||||||||||||||
|
Жалпы мақсаты |
- оқушыларға металдар тақырыбы бойынша алған білім-білік дағдыларын қалыптастыруда есептер шығаруға үйрету, оқушылардың интеллектуалдық деңгейін арттыру. - оқушылардың ой-белсінділігін арттыра отырып,нақты және жүйелі шешім қабылдауға, бейметалдар мен металдар туралы алған білімдерін кеңейтіп, ой-өрісін, зейінін дамыту. - шығармашылық ізденістерін, іскерлік дағдыларын, пәнге, білімге қызығушылықтарын арттыра отырып, өз бетімен білім ала білуге тәрбиелеу. |
|
|||||||||||||||||||||||||||||||||||||||||
|
Міндеттері: |
1. Өтілген тақырып бойынша оқушылардың білімдерін қорытындылау,материалды меңгеру дәрежесін бекіту; Оқушылар тәжірибе арқылы генетикалық байланыстарды іс жүзінде жүзеге асыруға теориялық білімдерін қолдану; 2. Оқушылардың сақталған ақпаратты қайта қолдану қабілетін және өз ойын қорыта айта алу біліктілігін дамыту; 3. Оқушыларды топтық ынтымақтастыққа тәрбиелеу |
|
|||||||||||||||||||||||||||||||||||||||||
|
Сілтеме |
Қосымша материалдар: “Анорганикалық және бейорганикалық химия” Ж.Шоқыбаев. Алматы "Қайнар", 1992 ж, Химия 8-11 сыныптар “Сандық есептер шығару әдістемесі” М.Б.Усманова, Қ.Н.Сақариянова. Алматы “Атамұра” 2004 ж. “Химиядан дидактикалық материалдар” Авторлары: Н.Н.Нұрахметов, Қ.Б.Бекішев, Н.А.Заграничная. Алматы"Мектеп" 2003ж |
|
|||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||
|
Оқу нәтижесі
|
- теориялық білімдерін жүйелеп, генетикалық байланысты жазады; - іске асыру теңдеулерін жаза отырып, есептерді жүйелі шығарады; - топтық жұмыста ұйымшылдыққа үйренеді. |
|
|||||||||||||||||||||||||||||||||||||||||
|
Негізгі идеялар |
Металдар, бейметалдар, оксид, негіз, қышқыл, тұздар, генетикалық байланыс |
|
|||||||||||||||||||||||||||||||||||||||||
|
Ресурстар және керекті құрал-жабдықтар, реактивтер
|
Интернет материалын пайдаланады.Бекетовтың электрохимиялық кернеу қатары кестесі, интерактивті тақта, смайликтер, бағалау парағы, қима қағаздар,рефлексия парағы, тапсырмалар парағы, стикерлер, маркерлер. |
|
|||||||||||||||||||||||||||||||||||||||||
|
Сабақ типі:
Сабақтың түрі: |
Қорытынды сабағы Кіріктірілген сабақ. Химия + ағылшын тілі |
|
|||||||||||||||||||||||||||||||||||||||||
|
Оқыту формасы, технологиясы, әдіс-тәсілдер |
Үй тапсырмасын жоғары және төмен дәрежелі сұрақтар арқылы тексеру, топтық жұмыс: жаңа білімді меңгерту, жетектеуші сұрақтар, ой бөлісу, бағалау әдістері, сыни тұрғыдан ойлау стратегиялары – блум таксономиясы, деңгейлік тапсырмалар. |
|
|||||||||||||||||||||||||||||||||||||||||
|
С а б а қ б а р ы с ы : |
|
||||||||||||||||||||||||||||||||||||||||||
|
Сабақ кезеңдері |
Мұғалім әрекеті |
Оқушы әрекеті |
|
||||||||||||||||||||||||||||||||||||||||
|
Кіріспе Психологиялық дайындық
1.Білу “Ой түрткі”
2. Түсіну
|
І. Ұйымдастыру кезеңі (3мин): А) Оқушылармен сәлемдесу Б) Сыныпты 3 топқа болу В) Топбасшысын сайлату С)Бағалау парақшасын тарату Д) Бағалау критерийлеріне түсінік беру
ІІ. Топқа бөлу: Оқушыларды химиялық элементтердің жіктелуі арқылы 3 топқа бөлемін. Әр оқушыға химиялық таңбалары жазылған қима қағаздар таратылады .Солар бойынша: І топ: Металдар ІІ топ: Бейметалдар ІІІ топ: Айнымалы элементтер Әр топ өздерінің топ басшыларын сайлайды. Топ ережесін шығарады. Бағалау парағы таратылады. Тапсырма № 1. "Ой түрткі" арқылы үй тапсырмасы сұралады. Қолдарындағы таңбаларды қазақша және ағылшынша атап шығады. Элементтер тобы:
Тапсырма № 2. "Ой қозғау" Элементтердің периодтық жүйедегі орны мен атом құрылысын сипаттайды. Жеке жұмыс.
1. Есептер шығару. Топ басшылары есептейді. І топ Құрамында 4℅ қоспасы бар 20г әктастан 12г кальций оксиді алынған .Алынған өнімнің шығымын тап ІІ топ Массасы 10г натрий гидроксиді мен 20г тұз қышқылы әрекеттескенде түзілген тұздың массасын тап ІІІ топ Массалық үлесі 20℅ 150г күкірт қышқылы мырышпен әрекеттескенде қ.ж. неше көлем сутегі газы бөлінеді?
|
Мұғаліммен амандасады. Кезекші оқушы ағылшын тілінде түгендейді, көңіл-күйлерін біледі. Date lesson.Дата урока ________ Good morning/ good afternoon! I’m glad to see you! Sit down, please. Are you ready? Listen to me. What date is it today ? Today is ____ . The theme of our lesson is -“ Metals against non-metals”. Let’s start ! Open your copybooks and write down the date, class work, and the theme of the lesson. Оқушылар химиялық химиялық элементтердің жіктелуі арқылы 3 топқа бөлінеді. Топ басшысын сайлайды.Топ ережесін шығарады. Бағалау парағына топ басшысы өз тобындағы оқушылардың жауап беруіне қарай бағалап отырады.
Оқушылар флипчартта жазылған тапсырмалар орындалады. Ағылшынша жазылған тапсырмаларға ПЖ пайдалана отырып жауап береді. Топ басшысы жауап берген оқушыларды бағалау парағына бағалап отырады. Оқушы тапсырманы жекелей орындайды.
|
|
||||||||||||||||||||||||||||||||||||||||
|
3.Қолдану
|
Сабақ тақырыбы: Металдар мен бейметалдар және оның қосылыстарының арасындағы генетикалық байланыс Оқушылармен бірге бүгінгі сабаққа мақсат қою.
Тапсырма № 3. Презентация қорғау. /ағылшын тілінде/ І топ: Металдар мен олардың қосылыстары.
Metal A metal is an element, compound, or alloy that is a good conductor of both electricity and heat. Metals are usually malleable, ductile and shiny, that is they reflect most of incident light. In a metal, atoms readily lose electrons to form positive ions (cations). Those ions are surrounded by de-localized electrons, which are responsible for the conductivity. The solid thus produced is held by electrostatic interactions between the ions and the electron cloud, which are called metallic bonds. Metals are sometimes described as an arrangement of positive ions surrounded by a sea of delocalized electrons. Metals occupy the bulk of the periodic table, while non-metallic elements can only be found on its right-hand side. A diagonal line, drawn from boron (B) to polonium (Po), separates the metals from the nonmetals. Most elements on this line are metalloids, sometimes called semiconductors. This is because these elements exhibit electrical properties common to both conductors and insulators. Elements to the lower left of this division line are called metals, while elements to the upper right of the division line are called nonmetals. An alternative definition of metal refers to the band theory. If one fills the energy bands of a material with available electrons and ends up with a top band partly filled then the material is a metal. This definition opens up the category for metallic polymers and other organic metals. These synthetic materials often have the characteristic silvery gray reflectiveness (luster) of elemental metals. Metals are amongst our most important resources. Most of the elements in Periodic Table are metals and they have a wide variety of uses. The general physical properties of metal are as follows. Metals are:
These properties make metals suitable for a large number of uses.
ІІ топ: Бейметалдар мен олардың қосылыстары. Non-metal Nonmetal, or non-metal, is a term used in chemistry when classifying the chemical elements. On the basis of their general physical and chemical properties, every element in the periodic table can be termed either a metal or a nonmetal. (A few elements with intermediate properties are referred to as metalloids). The elements are the ingredients that make up everything on the Earth. Not even a quarter of them are non-metals. But non-metals are the stuff of life. The air you breathe is made of non-metals. So are the clouds, rain, rivers, and oceans. Your body is two-thirds water, which carbon and nitrogen your other main ingredients. Your food is almost one hundred percent non-metal. Even down in Earth’s crust, oxygen is the most common constituent in rocks. Unlike metals, the non-metals are mostly gases or liquids at room temperature. Cool them enough and they form crumbly solids that do not conduct electricity. The non-metals are found together on the right of the periodic table. But that’s as close as they get. The group at the end is so aloof it is called noble, while its neighbours the halogens are a highly reactive group. The elements generally regarded as nonmetals are:
There is no rigorous definition for the term "nonmetal" - it covers a general spectrum of behavior. Common properties considered characteristic of a nonmetal include:
Only eighteen elements in the periodic table are generally considered nonmetals, compared to over eighty metals, but nonmetals make up most of the crust, atmosphere and oceans of the earth. Bulk tissues of living organisms are composed almost entirely of nonmetals. Most nonmetals are monatomic noble gases or form diatomic molecules in their elemental state, unlike metals which (in complete this table: their elemental state) do not form molecules at all.
ІІІ топ: Металдар мен бейметалдардың ұқсастықтары мен айырмашылығы. Венн диаграммасын толтырады. /қазақша/
|
Оқушылар жаңа тақырыпты меңгереді.
Слайд арқылы жасаған постерлерін қорғайды. Осы арқылы жаңа тақырып ашылады. Топтар бір-бірлерін смайликтер арқылы бағалайды. Жауап берген оқушыларды топ басшысы бағалау парағына бағалап отырады.
|
|||||||||||||||||||||||||||||||||||||||||
|
4.Талдау
|
“Кім жүйрік” ойыны Генетикалық байланыс туралы түсінік. . Биологияда. Генетика деп – тұқым
қуалаушылық пен өзгергіштікті зерттейтін ғылым екен. Биологияда генетика бөлімінде мынандай
сызбанұсқа бар.
Тапсырма № 4. Жұмбақтар: І топ: Күміс түсті металл өзі. Ақ бор, әктас мәрмар еді. Жер металы десек те, Сан құрылыстың өзегі. (Кальций) Ca → CaO → Ca(OH)2 → CaCO3 → Ca(HCO3)2 ІІ топ: Қара жер адамзатқа болған мекен, Қазына іші толған әр түрлі екен. Ішінде жүз мың түрлі асылы бар. Солардың ең артығы немене екен? (Темір) Fe→ FeCl2 → Fe(OH)2 → Fe(OH)3 → Fe2O3 → Fe ІІІ топ: Болмаса да айтарлықтай салмағым, Мен көбіңнен ардақтымын, алдамын. Ұшақ болып аспанға ұшып, қалықтап. Жердің жүзін, көк аспанды шарладым. Дюралюминий дейтін менің қоспамды Әспеттейді химияның достары. Осыларға төсек, үстел, ыдыс пен Бағандардың бұйдаларын қос тағы. Қағаз да мен қант – шайды сәндеген, Тоққа балқып келіп тұрған ән де мен. (Алюминий) Al → Al2O3 → AlCl3 → Al(OH)3 → Al(NO3)3
Бағалау. Бағалау парағына топ басшысы жауап берген оқушыларды бағалайды. |
Бұл тапсырмаларда Оқушылар берілген жұмбақтарды шешіп, Сол тапқан элементке генетикалық байланыс құрып, іске асыру теңдеулерін орындайды. Берілген тапсырмаларды оқушылар жеке орындайды, жұптық және топтық талқылайды, бір-бірін топтық бағалайды жұлдызшаларменТапсырманы бірінші аяқтаған топ марапатталады: Жарайсың, сенің қолыңнан келеді!!! (Вербальді бағалау).Топ басшысы өз тобының оқушыларының жұмыстарын қарап, бағалап отырады.Бағалау парағына бағаларын түсіріп отырады.
|
|||||||||||||||||||||||||||||||||||||||||
|
5.Жинақтау
|
Топтық жұмыс. “Асулардан асайық” Тапсырма № 5. Кроссворд шешу, ПЖ пайдалану.
Жауаптары: 1.Carbon 2.Hydrogen 3. Europium 4.Magnesium 5.Iron 6.Sulfur 7. Titanium 8. Radium 9. Yttrium
|
Бұл тапсырмаларда оқушылар бірігіп шығарып жарысады.
|
|||||||||||||||||||||||||||||||||||||||||
|
6. Бағалау
|
1)Бекіту сұрақтары: Ø Генетикалық байланыс деген не? Ø Ме мен БейМе – дар арасындағы генетикалық байланыстың ұқсастықтары мен айырмашылықтары қандай?
2)Тақырыпты бағалау: 1 топ: Синквейн «Металдар» 2топ: «Иә, жоқ» 3топ: рефлексия аңылшын тілінде айтады. 3) Оқушыларды бағалау. Сабақ барысындағы жұмыстары бойынша, сабақ критерийлеріне сәйкес оқушыларды бағалап отырған топ басшылары өз бағаларын айтады, сыныппен кеңесе отырып бағалаймын, бағаға түсініктеме беріп, жетілу жолдарын айтамын.
3)Үйге тапсырма: «Металдардың табиғатта жіне адам өміріндегі маңызы» эссе жазу. Тақырыпты оқу, интернет материалдарынан қосымша мәліметтер жинақтап, әкелу. Ә.Темірболатова Есептер жинағынан тақырыпқа байланысты есептер шығару.
Бүгінгі сабақта ұнады -------------
ұнамады-----------------
Менің көңіл –күйім:
- Сабақ аяқталды! - Сау болыңыздар! |
Оқушылар тақырып бойынша алған білімдерін қорытындылайды.
Оқушылар бағаланады. Сабақ барысындағы жұмыстары бойынша, сабақ критерийлеріне сәйкес оқушыларды бағалап отырған топ басшылары өз бағаларын айтады.
Сабақтан алған әсерін баяндайды. Кей оқушы сыныпқа оқып береді. |
|||||||||||||||||||||||||||||||||||||||||
Металдар мен бейметалдар және олардың
қосылыстарының арасындағы генетикалық байланыс.
Сабақ тақырыбы:Металдар мен бейметалдар және олардың қосылыстарының арасындағы генетикалық байланыс
Сабақтың мақсаты: Металдар мен бейметалдар және олардың қосылыстарының арасындағы генетикалық байланыстар туралы білімді қорытындылау.
Міндеттері:
2. Өтілген тақырып бойынша оқушылардың білімдерін қорытындылау,материалды меңгеру дәрежесін бекіту;
Оқушылар тәжірибе арқылы генетикалық байланыстарды іс жүзінде жүзеге асыруға теориялық білімдерін қолдану;
2. Оқушылардың сақталған ақпаратты қайта қолдану қабілетін және өз ойын қорыта айта алу біліктілігін дамыту;
3. Оқушыларды топтық ынтымақтастыққа тәрбиелеу
Сабақ типі: Жаңа білім беру сабағы
Сабақтың түрі: Аралас сабағы
Әдісі:Есептершығару, сұрақ-жауап,демонстрация,есептершығару,ойындар,деңгейлік тапсырмалар, академиялық дау-дамай, болжау әдісі
Сабаққа қажетті құралдар: интерактивті тақта, маркер, А1 форматты қағаз, түсті қағаздар, химиялық реактивтер, химиялық ыдыстар.
Көрнекіліктер: слайдты көрсетілімдер, қима қағаздар, химиялық элементтердің периодтық жүйесі кестесі,тақта, бор.
Пәнаралық байланыс: қазақ тілі,медицина,биология, сурет,география
Күтілетін нәтиже:
Теориялық білімдерін шыңдайды;
Есептің шығару жолын түсіндіреді;
Генетикалық байланыстарды жүзеге асыра алады;
Топтық жұмыста ұйымшылдыққа үйренеді
Сабақтың эпиграфы:Зерттеп білмейінше білу де, істей алу да мүмкін емес.
Б.Момышұлы
Сабақтың жоспары:
І. Ұйымдастыру кезеңі (3мин):
А) Оқушылармен сәлемдесу
Б) Сыныпты 4 топқа болу
В) Топбасшысын сайлату
С)Бағалау парақшасын тарату
Д) Бағалау критерийлеріне түсінік беру
ІІ.Үй тапсырмасын тексеру
2. Есептер шығару
І топ
Құрамында 4℅ қоспасы бар 20г әктастан 12г кальций оксиді алынған .Алынған өнімнің шығымын тап
ІІ топ
Массасы 10г натрий гидроксиді мен 20г тұз қышқылы әрекеттескенде түзілген тұздың массасын тап
ІІІ топ
Массалық үлесі 20℅ 150г күкірт қышқылы мырышпен әрекеттескенде қ.ж. неше көлем сутегі газы бөлінеді?
І V топ
Массасы 30 г мыс пен алюминий қоспасына концентрациялы азот қышқылымен әсер еткенде 13,44 л газ (қ.ж.) бөлінді.Қоспаның құрамын анықтаңдар.
2. «Ауызша есептер» (8 мин)
1. Темірдің (ІІ) оксидінің салыстырмалы молекулалық массасы нешеге тең? (72)
2. 45 г судағы моль саны нешеге тең? (2,5 моль)
3. 11,2 моль судың массасын есептеңдер? (201,6 г)
4. 32 г күкірттің зат мөлшері нешеге тең? (1 моль)
5. 2 моль оттек көлемін табыңдар? (44,8л)
6.5л сутектің зат мөлшері нешеге тең? 0,22 моль)
7. Массасы 177.5г хлордың (қ.ж.)көлемі (56 л)
8. 2 моль темірдің атом санын тап (12,04*10 23)
9. 0,2 моль газдың көлемін (қ.ж.) есептеңдер.
10. Массасы 22 г көмірқышқыл газының көлемін (қ.ж.) табыңдар. (11,2л )
11. газдың 1 литрінің (қ.ж.) массасы 1,875 г. Осы газдың молярлық массасын табыңдар. (42 г/моль)
12. 1 моль азоттың массасы нешеге тең? (28 г)
4. « О й шақыру» (4 мин)
1. Темірдің маңызды құймаларын атаңыздар?
2. Шойын мен болаттың басты айырмашылығы қандай?
3. Шойынның қандай түрлерін білесіңдер?
4. Шойыннан болат дайындау дегенді қалай түсінесіңдер?
5. Легирленген болат дегенді қалай түсінесіздер және құрамына қандай элементтер кіреді?
Үй тапсырмасын бекіту, қорыту:
«Мен не білдім?»
« Сабақ мен үшін түсінікті болды немесе түсініксіз болды?»
ІІІ Жаңа сабаққа көшу
(Қызығушылығын ояту)
«Болжау әдісі» (3 мин)
|
K Li CaO Na SO3 CO2 H2SO4 NaOH CaCO3 Байланыс «Ген» C P Коваленттік полюсті Иондық байланыс |
1.Бұл сөздерді не үшін ұсынып отырмын?
2. Әңгіме төркіні не туралы болмақ?
3. Қандай мағыналар береді?
Оқушылар жауабымен келісі отырып, келесі болжамды ұсыну.
Реакция теңдеуді жазу.
ІV. Жаңа сабақ
Жаңа сабақтың тақырыбы: «Металдар мен бейметалдар,олардың арасындағы генетикалық байланыс»
Оқушылармен бірге бүгінгі сабаққа мақсат қою.
Ерте-ерте, ертеде,ешкі құйрығы келтеде, химияның жерінде, элементтер елінде «бейорганика» деген шал өмір сүріпті.Оның 4 ұлы болыпты.Ал, кәне балалар осы 4 ұлдың атын атай қойыңдаршы:
1.Оксид
2. Негіз
3.Қышқыл
4. Тұз
Бір күні шал балаларын жинап алып, өсиет айтыпты: «Балаларым, мен қартайдым, төрімнен көрім жақын.Талапты азамат ертеңгі күнін ойлар, бір апта уақыт беремін, жан-жақты зерттеп, шарлап, әрқайсыңның жаныңа сүйеніш, өміріңе азық болар зат әкеліңдер», - депті.
Ұлдары әке сөзін құп алып, жол жүріп кетіпті.Уәделі күні сапардан балаларының бәрі оралып, олжаларымен бөлісіпті.
Оқушылар «Бейорганика» шалдың балалары қандай олжа әкеліпті?
Бейорганика шал : бұларыңа өте дән ризамын, балаларым, алдағы уақытта бір-біріңнен ажырамай бірге өмір сүріңдер деген екен.
Балалары ақылдаса келіп,қасынан үй салып,үйдің арасын бір-бірімен байланыстырып,дуалмен біріктіріп қоршапты.Содан бері олар бірнен-бірі ажырамай, мынадай тізбек құрып,араласып тұратын болыпты.Олардың қасиеттерін жақсы білетін жақын көршілері ғана болмаса, оларды бірінен-бірі ажырата алмай қалады екен.
« Сақина салмақ» ойыны.
Ойын шартымен таныстырып, ойынды өзім бастаймын.
Мынадай өзгерулерді іске асыруға болатын реакция теңдеулерін жазыңдар:
CuSO 4 →Cu →CuO→CuCI2→Cu(OH) 2→Cu(OH)NO3 →Cu(NO3)2
Шешуі:
1.Орын басу реакциясы арқылы мыс (ІІ) тұзынан мысты алуға болады:
CuSO4 +Fe→FeSO4 +Cu
2) Мысты оттегіде жағып,мыс (ІІ) оксидін аламыз:
2Cu + О 2 =2CuO
3) Мыс (ІІ) оксиді тұз қышқылында еріп, мыс (ІІ) хлоридін түзеді:
CuO +2НСІ = CuCI2 + Н2О
4) Мыс (ІІ) хлориді ерітіндісіне сілті ерітіндісін қосып,мыс (ІІ) гидроксидін алуға болады: CuCI2 + 2 КОН = Cu(OH) 2+ 2 КСІ
5) Мыс (ІІ) гидроксидін бір гидроксотобының орнын алатындай мөлшерде алынған азот қышқылымен яғни 1 моль Cu(OH)2 1 моль НNO3–пен өңдеп мыс (ІІ) гидроксонитратын –негіздік тұз алады:
Cu(OH)2 + НNO3= Cu(OH)NO3 +Н2О
6) Мыс (ІІ) гидроксонитратына артық азот қышқылымен әсер етіп, мыс (ІІ) нитратын алады:
Cu(OH)NO3 + НNO3= Cu(NO3)2 + Н2О
Ал,балалар, «Бейорганика » шал оның балаларының қасиеттері туралы деген генетикалық байланыс тапсырманы шешу сендерге тапсырылады.
V. Бекіту
А) «Ғажайып тәжірибе»
Қауіпсіздік техникасының ережелерін қайталау.
І ,ІІ, ІІІ,ІV топ тәжірибе орындайды.
Қалған оқушыларға үлестірмелі қағаз таратылып, постерге тапсырмалар орындалайды.
VІ. Қорытынды.
«Академиялық дау-дамай»
«Металдар мен бейметалдар,олардың қосылыстарының тіршілік үшін пайдасы мен зияны» туралы ой ойларын дәлелдей отырып, топтар өзара пікірталасқа түседі.
VІІ. Рефлексия
Бүгінгі сабақта мен не үйрендім?
Маған сабақ кезеңдерінде не ұнады, не ұнамады?
Өтілген материал бойынша сұрақ немесе пікірің?
VІІІ. Бағалау.
1)Топбасшыларының бағалауы;
2) Жиынтықтық бағалау;
3) Өзін-өзі бағалау;
Күнделіктеріне баға қою.
ІХ.Үйге тапсырма.
Есептер мен жаттығулар бойынша № 10-15 есептер.
Қосымша үлестірмелі қағаз тарату.
Сабақтың тақырыбы Металдар мен бейметалдар
және олардың қосылыстарының арасындағы генетикалық
байланыс.
Сабақтың мақсаты Білімділік: оқушыларға
металдар тақырыбы бойынша алған білім-білік дағдыларын қалыптастыруда
есептер шығаруға үйрету, оқушылардың интеллектуалдық
деңгейін арттыру.
Дамытушылық: оқушылардың ой-белсінділігін
арттыра отырып,нақты және жүйелі шешім қабылдауға,
бйметалдар мен металдар туралы алған білімдерін кеңейтіп, ой-өрісін,
зейінін дамыту.
Тәрбиелік: шығармашылық ізденістерін,
іскерлік дағдыларын, пәнге, білімге қызығушылықтарын
арттыра отырып, өз бетімен білім ала білуге тәрбиелеу.
Күтілетін нәтиже 1. Теориялық білімдерін
жүйелей біледі.
2. Есептерді шығаруды үйренеді.
3. Генетикалық байланыстарды жүзеге асыра
алады.
4. Топтық жұмыста ұйымшылдыққа
үйренеді.
Көрнекі құралдар Слайд, «Ерігіштік
кестесі», Н.Н.Бекетовтің «Кернеулік қатары», Д.И. Менделеевтың
периодты жүйесі.
Сабақтың типі Жаңа білімді меңгерту.
Сабақтың түрі Аралас сабақ
Әдісі
Есептер шығару, түсіндіру, салыстыру,
сұрақ-жауап
Пән аралық байланыс Әдебиет, биология,
тарих, астрономия
Сабақтың өтілу барысы
Сабақтың кезеңдері Мұғалімнің
іс – әрекеті Тақырыптың (тапсырма) мазмұны Оқушы әрекеті
Уақыты
1 2 3 4 5
Ұйымдастыру Оқушылармен
амандасу, түгелдеу,
сабаққа даярлығын
қадағалау. Сандық есептер шығару.
«Ерітінділердегі және қоспалардағы әрекеттесуші заттардың
біреуі артық алынғандағы реакция теңдеуі бойынша есептеулер.
Мұғаліммен амандасады, сабаққа даяр отырады. 2 минут
Үй тапсырмасын сұрау Үйге берген
есептерді орындарынан тексеру.
Есептер:
1. Құрамында 7,4 г кальций гидроксиді
бар ерітінді арқылы 1,8л (қ.ж.) көмірқышқыл газы жіберіледі.
Түзілген тұнбаның массасын табыңдар.
2. Құрамында 12г мыс (ІІ) сульфаты бар
ерітіндіге 8г темір үгіндісі салынды. Осы кезде неше грамм тұз түзілгенін
есептеңдер.
І кезең «Қызығушылықты ояту»
- топтастыру стратегиясы
Үйге берген тапсырма бойынша сабаққа
дайындалады.
2 минут
Жаңа тақырыпты меңгерту Оқушыларға
генетикалық байланыстың шығу тегін, есептердің шығару
жолын үйретеді. Тақтада слайд көрсетеді. ІІ кезең «Мағынаны
ашу» - жаңа сабақ «Инсерт»
1. Периодтық кестедегі металдар мен бейметалдарды
өзара қалай бөліп көрсетеді?
Генетика – грекше «генезис» - «шығу тегі» немесе
«ұқсастық» дегенді білдіреді.
Генетикалық байланыс дегеніміз – жеке кластардың
өзара байланысы арқылы заттардың бір – біріне айналуы немесе бір
класс өкілінен екінші класс өкілін алуды генетикалық байланыс
дейміз.
1. VIII ғ. Күлтегін жазуында
былай жазылған (түріктер дәуірінде). Зат → Тәңірі,
Алла, Көк, Қара
аспан жер
↓ ↓ ↓ ↓
Адам Құдай Ата Ана
Құдай ата – ананы жаратқан одан
Адам пайда болған екен. Яғни, генетикалық байланыс пайда болып
тұр.
2. Әдебиетте: Қазақтың ұлы
ақыны философ Ш.Құдайбердіұлы «Үш анық» еңбегінде:
«дүниенің тірегі - атом және сол атомның 5 тірегі бар олар
бір-біріне өзара айналып отырады» - деген. Олар: туды, өлді, жанды,
сөнді, өршіп өнеді.
3. Астрономиямен генетикалық ұғымды
былай байланыстыруға болады. Б.э.д. 384 ж өмір сүрген ғалым,
философ Аристотель алғашқы 4 элемент туралы теория ұсынды. Әлем
4 элементтен тұрады: ауа, от, жер, су. Егер, осы заттың біреуі өзгерсе,
қалғаны бір – біріне айналады деген екен. От → жер → су
→ ауа → от.
4. Биологияда. Генетика деп – тұқым қуалаушылық
пен өзгергіштікті зерттейтін ғылым екен. Биологияда генетика
бөлімінде мынандай сызбанұсқа бар.
Ата – ана → ген → ұрпақ.
5. Химияда.
Металл → негіздік оксид→ негіз
→ тұз
Бейметалл → қышқылдық
оксид → қышқыл → тұз
Мұғалімді тыңдап,
тақырыпты бірге талдайды.
8 минут
Бекіту Оқушыларға тақырып
бойынша есептер береді. ІІІ кезең «Ой толғаныс» - бекіту
тапсырмалары (қосымша тіркеуде)
1. Жұмбақтар:
1. Күміс түсті металл өзі.
Ақ бор, әктас мәрмар еді.
Жер металы десек те,
Сан құрылыстың өзегі.
(Кальций)
Ca → CaO → Ca(OH)2 → CaCO3
→ Ca(HCO3)2
2Ca + O2 → 2CaO
CaO + 2H2O → Ca(OH)2↓
Ca(OH)2 + CO2 → CaCO3↓ + H2O
CaCO3 + H2O + CO2 = Ca(HCO3)2
2. Қара жер адамзатқа болған
мекен,
Қазына іші толған әр
түрлі екен.
Ішінде жүз мың түрлі асылы
бар.
Солардың ең артығы немене
екен?
(Темір)
Fe→ FeCl2 → Fe(OH)2 → Fe(OH)3
→ Fe2O3 → Fe
Fe + 2HCl → FeCl2 + H2
FeCl2 + 2NaOH → Fe(OH)2 + 2NaCl
4Fe(OH)2 + O2 + H2O → 4Fe(OH)3
2Fe(OH)3 = Fe2O3 + 3H2O
Fe2O3 + 2Al = 2Fe + Al2O3
3. Болмаса да айтарлықтай салмағым,
Мен көбіңнен ардақтымын,
алдамын.
Ұшақ болып аспанға ұшып,
қалықтап.
Жердің жүзін, көк аспанды
шарладым.
Дюралюминий дейтін менің қоспамды
Әспеттейді химияның достары.
Осыларға төсек, үстел, ыдыс
пен
Бағандардың бұйдаларын
қос тағы.
Қағаз да мен қант – шайды
сәндеген,
Тоққа балқып келіп
тұрған ән де мен.
(Алюминий)
Al → Al2O3 → AlCl3 → Al(OH)3
→ Al(NO3)3
4Al + O2 = 2Al2O3
Al2O3 + 6HCl = 2AlCl3 + 3H2O
AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl
Al(OH)3 + 3HNO3 = Al(NO3)3 + 3H2O
2. Адасқан формулалар
1) Na → X → Na2SO4 →Ba2SO4
4Na + O2 → 2Na2O
Na2O + H2SO4 → Na2SO4 + H2O
Na2SO4 + BaCl2 → BaSO4 + 2NaCl
2) S → SO2 → Y → H2SO4 →
MgSO4
S + O2 → SO2
2SO2 + O2 → 2SO3
SO3 + H2O → H2SO4
H2SO4 + Mg(OH)2 = MgSO4 + 2H2O
3) SiO2 → X → SiO2 → Na2SiO3
→ H2SO4 → SiO2
SiO2 + 2Mg → 2MgO + Si
Si + O2 → SiO2
SiO2 + 2NaOH → Na2SiO3 + H2O
Na2SiO3 + H2SO4 → Na2SO4 + H2SiO3↓
H2SiO3 → SiO2 + H2O
3. Жұмбақтас (химиялық
жұмбақ)
Жаздың жанға жайлы
күндерінің бірінде Алмас шопан атасының үйіне
демалуға келеді. Көмекші немересінің келгеніне атасы
қатты қуанады. Бір күні қой жайып жүріп, Алмас
қара тас тауып алады. Онымен сурет салып көрді де қара із
қалдыратынын байқады. Түсте от жағып, сүт пісіріп
ішіп, маужырап ұйқысы келеді. Бала ұйықтап кеткенде
қолындағы тасы сусып, отқа түсіп кетеді. Тас от алып түтінденеді.
Осы кезде жауған өткінші жаңбыр түтінді жерге
сіңіреді. Одан ауыр әкті су ағады. Жарқырап күнде
шықты. Күн сәулесінің жылуынан әр жерде
әкті су, ұзақ кепкен ақ тастар шашылып жатады,
оянған Алмас жаңбырдың қара тасты ақ тасқа
қалай айналдырғанын көріп таң тамаша болады. Ақ
тасты алып жерге жазып, сызып көреді. Оның да өзіндік ізі
бар. Қара тас не? Ақ тас қалай пайда болады?
Жауабы: C → CO2 → H2CO3 →
Ca(HCO3)2 → CaCO3
7000
C + O2 → CO2
CO2 + H2O → H2CO3
2H2CO3 + Ca(OH)2 →Ca(HCO3)2 + 2H2O
t0
Ca(HCO3)2 = CaCO3↓ + CO2↑ + H2O
4. Кім жүйрік?
№1 есеп.
Массасы 60г пиритті темір(ІІІ) гидроксидін алу
мақсатында мына тізбек бойынша химиялық айналуларға
ұшыратқан:
FeS2→Fе2O3 →FeCl3 →Fe(OH)3
Егер барлық реакциялар реактивтердің
жеткілікті мөлшерімен және шығынсыз жүргізілсе,
соңғы өнімнің массасы қандай болғаны?
№2 есеп.
Азот қышқылын ауадағы азоттан
мына айналулар тізбегі бойынша:
N2 →NH3→ NO →NO2→ HNO3
Егер барлық реакциялар реактивтердің
жеткілікті мөлшерімен және шығынсыз жүргізілсе, 126г
азот қышқылын алу үшін ауаның қандай көлемі
қажет?
№3 есеп.
Құрамында 65% темір колчеданы бар 1
тонна кеннен шығымы 85% болғанда массалық үлесі 40%
тығыздығы 1,037 г/мл қанша көлем күкірт
қышқылын алуға болады?
Берілген есептерді тақтада шығарып,
талдау. 30 минут
Қорытындылау Жаңа сабақты
игере, қорыта отырып оның жетістіктері туралы айтады. Жай заттан
бастап әр күрделі заттың өзіне тән
ұқсас және әртүрлі қасиеттері байқалады.
Соған байланысты олардың бір – біріне айналу
заңдылықтары ескеріледі. Мысалы, бастапқы жай зат металл
болса, ол оттекке қосылып, негіздік оксид береді. Олар негіздер класына
ауысып, одан тұз алуға болады. Егер жай зат бейметалл болса,
алдымен қышқылдық оксид, ал одан әрі қышқылға
айналып, ақыры тұз алуға мүмкіндік туады.
Мұғалімді тыңдап,
бағаланады. 1 минут
Үйге тапсырма беру Әр топқа 2
іске асыру теңдеулерін құрып келулерін тапсырады. Бейметалдар
мен металдарға іске асыру теңдеуін құру. Үйге
берген тапсырманы дәптерлеріне белгілеп алады. 1 минут
Бағалау Оқушыларды жауап беру деңгейлері
ойынша бағалау. 1. Мәтінді түсінбеген, тақырыпты аша
алмады
2. Мәтінді түсінген,
мазмұндауда жоспардан ауытқу бар
3. Мазмұны тақырыпқа сай
көп фактілер бұрмаланған
4. Мазмұны тақырыпқа сай
келеді, бірақ ойын баяндауда дәлсіздіктер кездеседі
5. Мазмұны тақырыпқа сай
бірақ қажетті қорытындылар жасай алмады
6. Мазмұны тақырыпқа сай,
мәтінді толық түсінген, тақырып ашылған,
өзіндік ой-пікірін орынды қолданған.
Бағаланып, үзіліске шығады. 1
минут
Қосымша тіркеу
Үй тапсырмасы:
1. Құрамында 7,4 г кальций
гидроксиді бар ерітінді арқылы 1,8л (қ.ж.)
көмірқышқыл газы жіберіледі. Түзілген
тұнбаның массасын табыңдар.
Шешуі:
Ca(OH)2 + CO2 = CaCO3↓ + H2O
ν(Ca(OH)2) = 7,4 г/74 г/моль = 0,1 моль
ν(CO2) = 1,8л/22,4 л/моль= 0,08 моль
ν(Ca(OH)2) = ν(CO2) = 0,08 моль
m(CaCO3) = 0,08 моль * 100 г/моль = 8 г
2. Құрамында 12г мыс (ІІ) сульфаты
бар ерітіндіге 8г темір үгіндісі салынды. Осы кезде неше грамм тұз
түзілгенін есептеңдер.
Шешуі:
12г 8 г
CuSO4 + Fe → FeSO4 + Cu
160 56 152г/моль
ν(CuSO4) = 12/160 г/моль = 0,075 моль
ν(Fe) = 8/56г/моль = 0,1428 моль
ν(CuSO4) = ν(FeSO4) = 0,075 моль
m(FeSO4) = ν(FeSO4) * М(FeSO4) = 0,075моль
* 152г/моль = 11,4г
ІІІ кезең «Ой толғаныс» - бекіту
тапсырмалары
4. Кім жүйрік?
№1 есеп.
Массасы 60г пиритті темір(ІІІ) гидроксидін алу
мақсатында мына тізбек бойынша химиялық айналуларға
ұшыратқан:
FeS2→Fе2O3 →FeCl3 →Fe(OH)3
Егер барлық реакциялар реактивтердің
жеткілікті мөлшерімен және шығынсыз жүргізілсе,
соңғы өнімнің массасы қандай болғаны?
Бер:
m(FeS2) = 60г
Т/к: m(Fe(OH)3)= ?
Шешуі:
60г х г
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
ν=60г/120г/моль= 0,5моль (FeS2)
4ν(FeS2)=2ν(Fe2O3)=0,5моль/2=0,25моль
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
ν(Fe2O3)=2ν(FeCl3)=0,25моль*2=0,5моль
FeCl3 + 3KOH → Fe(OH)3 + 3KCl
ν(FeCl3)=ν(Fe(OH)3)=0,5моль
m=0,5моль*107г/моль=53,5 г
Жауабы: m(Fe(OH)3)= 53,5 г
№2 есеп.
Азот қышқылын ауадағы азоттан
мына айналулар тізбегі бойынша:
N2 →NH3→ NO →NO2→ HNO3
Егер барлық реакциялар реактивтердің
жеткілікті мөлшерімен және шығынсыз жүргізілсе, 126г
азот қышқылын алу үшін ауаның қандай көлемі
қажет?
Бер:
m(HNO3)=126г
Т/к: v(ауа)=?
Шешуі:
Х г 126 г
2NO2 + H2O = HNO3 + HNO2
ν=126г/63г/моль=2моль
2ν(NO2)=ν(HNO3)=2моль*2=4моль
2NO + O2 = 2NO2
2ν(NO)=ν(NO2)=4моль
4NH3 + 5O2 = 4NO + 6H2O
4ν(NO)=4ν(NН3)=4моль
V=4моль/22,4л/моль= 0,18л
0,18 л --- 100%
Х л --- 21%
х = 0,0378л
№3 есеп.
Құрамында 65% темір колчеданы бар 1
тонна кеннен шығымы 85% болғанда массалық үлесі 40%
тығыздығы 1,037 г/мл қанша көлем күкірт
қышқылын алуға болады?
Бер:
m(руда) = 1000 кг
ω(FeS2)=65%
ω(H2SO4)=40%
ρ(H2SO4)=1,307
Ŋ(H2SO4)=85%
Т/к: v(H3PO4)=?
Шешуі: 4FeS2 + 11O2 =
8SO2 + 2Fe2O3
2SO2 + O2 = 2SO3
SO3 + H2O = H2SO4
FeS2 → H2SO4
ν(FeS2)=1 моль; ν(H2SO4)=1 моль
m(FeS2)= 1моль*120г/моль=120г; m(H2SO4)=2моль*98г/моль = 196г
1000 кг(руда) --- 100%
Х кг --- 65%
Х = 650 кг
120 г(FeS2) --- 196 г (H2SO4)
650 г(FeS2) --- х кг (H2SO4)
Х=1061,62 кг (H2SO4)
m(H2SO4)=1061,62кг
ω(ер.з)= *100%
1061,62 кг (H2SO4) --- 100%
Х кг(H2SO4)--- 85%
Х= 902,38 кг (H2SO4)
m(ер-ді)= *100%= =2255,9 кг
v(H2SO4)=m/ρ=2255,9*103/1,307=1726 л
Жауабы: v(H2SO4)=1726 л
Девиз урока: “Зажечь, увлечь и повести”.
Цели. В нетрадиционной форме обеспечить восприятие и осмысление понятий “простое вещество”, “металлы и неметаллы”; активизировать интерес учащихся к изучаемому предмету, формировать “химический” стиль мышления при обсуждении относительности деления элементов на металлы и неметаллы. Обобщить и систематизировать знания учащихся о классификации элементов: металлов и неметаллов; об их строении и свойствах. Продолжить формирование билингвистической культуры в изучении химии. Способствовать развитию эрудиции и познавательного интереса.
Задачи.
Образовательные:
Воспитательные:
Развивающие:
Обеспечить эмоциональное восприятие происходящего, создавая в ходе смотра ситуации, вызывающие удивление, интерес и так далее.
- Включить элементы опережающего обучения как базу для более легкого последующего усвоения знаний о строении и свойствах веществ.
Тип урока: обобщение знаний.
Вид урока: общественный смотр знаний.
Технология обучения
- проблемное обучение;
- кейс-технологиия;
- информационно-коммуникативные.
Методы, используемые на уроке:
- частично-поисковый;
- проблемный.
Средства наглядности:
- компьютерная презентация;
- видеоматериал;
- дидактические карточки.
практические:
- Решение экспериментальных задач.
дедуктивные:
- от известного к неизвестному;
- от простого к сложному.
Виды контроля:
- текущий опрос;
- работа по карточкам;
- групповой контроль.
Материалы и оборудование к уроку:
- мультимедийный проектор, компьютер, экран;
- интерактивная доска с загруженными Интернет-ресурсами;
- презентация с заданиями;
- таблицы растворимости;
- карточки с заданиями;
- экспериментальные задачи с растворами веществ:
- вода, напитки “Кола”, соков (апельсинового или др.), соды, мыла, универсальный индикатор.
Подготовка к уроку: Готовятся маршрутные листы для учащихся. Класс делится на 4 группы. Каждый экипаж выбирает себе консультанта (ученика, имеющего прочные знания по предмету). После каждого задания ученики отмечают в маршрутном листе отмечает этапы прохождения урока
План урока
1. Вступительное слово учителя.
2. Подготовка и выполнение заданий группами.
3. Изучение основных свойств простых веществ – металлов и неметаллов.
4. Составление обобщающей схемы и закрепление изученного материала.
5. Домашнее задание.
6. Заключительное слово учителя. Оценка работы учащихся на уроке.
Этапы урока:
Lesson.
Тема урока: Металлы против неметаллов. (“Metals against non-metals”)
Date lesson.Дата урока ________ Good morning/ good afternoon!
I’m glad to see you! Sit down, please.
Are you ready? Listen to me. What date is it today ? Today is ____ .
The theme of our lesson is -“ Metals against non-metals”.
Let’s start !
Open your copybooks and write down the date, class work, and the theme of the lesson.
На экране основная презентация- интерактивный урок
1. Органический момент.
2.Учащиеся класса разделяются на 3 группы. Для этого каждый ученик выбирает одну карточку, на которой написан знак элемента. Все элементы расписаны на карточках 3 цветов.
Группы элементов:
Каждый ученик берет карточку и называет элемент на русском и английском языках. Ученики рассаживаются по 3 группам.
1 этап.
Каждый ученик расписывает строение атома и положение своего элемента (2-3 мин.).
Приложение 1
|
С |
Порядковый номер- [ 1 ] Атомная масса – [ 1 ] Период – [ 1 ] Группа, подгруппа - [ 1 ] Число протонов- [ 1 ] Число нейтронов – [ 1 ] Число электронов – [ 1 ] Число уровней - [ 1 ] Распределение по уровням – [ 1 ] Электронная конфигурация атома – [ 1 ] Металл или неметалл- [ 1 ] Всего [ 12 ] |
|
С |
Atomic number- [ 1 ] Atomic relative mass – [ 1 ] Period – [ 1 ] Group - [ 1 ] Number of protons- [ 1 ] Number of neutrons – [ 1 ] Number of electrons – [ 1 ] Number of levels - [ 1 ] Electronic structure – [ 1 ] Electronic configuration – [ 1 ] Metal, non-metal or metalloid - [ 1 ] Total [ 12 ] |
Проверяют эти задания – жюри (ученики старших классов, или параллельных классов).
2 этап. Презентации (по 10 баллов).
Presentations (10 marks)
Каждая группа заранее готовит презентацию на английском языке о металлах, неметаллах и металлоидах.
Затем каждой группе выдается образец металла (медь, алюминий, магний и др.), металлоида (кремний) и неметалла (сера, углерод, йод). Ученики описывают физические свойства и должны доказать, почему данное простое вещество металл или неметалл (Приложение - презентации 1, 2, 3)
|
Metals |
Металлы |
|
Metals are a group of elements that share certain properties. |
Металдар- бұл элементтер тобы, өздеріне тән қасиеттері бар. |
|
They conduct heat and electricity well, that is why cooking pans and electrical wires are made of metal. |
Олар тоқты жақсы өткізеді. Сондықтан да жылуқткізгіш сымдар мен тұрмыстық табалар металдардан жасалады. |
|
They are also strong and can be shaped easily; That is why they are used to make structures such as bridges. |
Олар өте берік, иілімді болады. Сол себепті оларды құрылыста қолданылады. Мысалы, көпірлер құрылысында. |
|
Although there are a lot similarities between metals, there are also some differences that determine how suitable a metal is for a particular use. |
Металдарға тән жалпы қасиеттері мен бірге олардың өзіндік ерекшеліктері де болады. |
|
Of the 116 elements known today, 90 are metals. |
116 химиялық элементтердің ішіндегі , 90 металдар. |
|
They are rarely used in their pure state - they are usually mixed with other metals or nonmetals to form combinations known as alloys. |
Олар таза күйінде көп қолданылмайды. Олар әдетте басқа металдар мен бейметалдармен араластырылып қолданылады. Оларды құймалар деп атайды. |
Metal
A metal is an element, compound, or alloy that is a good conductor of both electricity and heat. Metals are usually malleable, ductile and shiny, that is they reflect most of incident light. In a metal, atoms readily lose electrons to form positive ions (cations). Those ions are surrounded by de-localized electrons, which are responsible for the conductivity. The solid thus produced is held by electrostatic interactions between the ions and the electron cloud, which are called metallic bonds.
Metals are sometimes described as an arrangement of positive ions surrounded by a sea of delocalized electrons. Metals occupy the bulk of the periodic table, while non-metallic elements can only be found on its right-hand side. A diagonal line, drawn from boron (B) to polonium (Po), separates the metals from the nonmetals. Most elements on this line are metalloids, sometimes called semiconductors. This is because these elements exhibit electrical properties common to both conductors and insulators. Elements to the lower left of this division line are called metals, while elements to the upper right of the division line are called nonmetals.
An alternative definition of metal refers to the band theory. If one fills the energy bands of a material with available electrons and ends up with a top band partly filled then the material is a metal. This definition opens up the category for metallic polymers and other organic metals. These synthetic materials often have the characteristic silvery gray reflectiveness (luster) of elemental metals.
Metals are amongst our most important resources. Most of the elements in Periodic Table are metals and they have a wide variety of uses. The general physical properties of metal are as follows.
Metals are:
These properties make metals suitable for a large number of uses.
Chemical properties of metals.
Metals are found on the left hand side of the Periodic Table. Most metals have similar chemical properties . The most important chemical reactions of metals are with oxygen, water and acids, which are common substances found in nature. Although the chemical properties of metals are similar, they do not all react exactly the same way. These differences in the way metals react can be used to develop a Reactivity Series of metals.

Uses of Metals
The uses of a material depend on the properties. Metals have a wide variety of useful properties and so are used for a number of different purposes. This does not mean, however, that all metals can do all jobs; some metals are better suited to certain tasks than others. For example:
Aluminum is used in high performance cars as it is lightweight and strong;
Iron is used for manhole covers as it is strong and cheap;
Copper is used for electrical cabling because it is a very good electrical conductor;
Gold is used in jewelry because it is very shiny and does not tarnish;
Steel is used in bridges because it is very strong and is not as brittle as iron.
Non-metal
Nonmetal, or non-metal, is a term used in chemistry when classifying the chemical elements. On the basis of their general physical and chemical properties, every element in the periodic table can be termed either a metal or a nonmetal. (A few elements with intermediate properties are referred to as metalloids).
The elements are the ingredients that make up everything on the Earth. Not even a quarter of them are non-metals. But non-metals are the stuff of life. The air you breathe is made of non-metals. So are the clouds, rain, rivers, and oceans. Your body is two-thirds water, which carbon and nitrogen your other main ingredients. Your food is almost one hundred percent non-metal. Even down in Earth’s crust, oxygen is the most common constituent in rocks.
Unlike metals, the non-metals are mostly gases or liquids at room temperature. Cool them enough and they form crumbly solids that do not conduct electricity.
The non-metals are found together on the right of the periodic table. But that’s as close as they get. The group at the end is so aloof it is called noble, while its neighbours the halogens are a highly reactive group.
The elements generally regarded as nonmetals are:
There is no rigorous definition for the term "nonmetal" - it covers a general spectrum of behavior. Common properties considered characteristic of a nonmetal include:
Only eighteen elements in the periodic table are generally considered nonmetals, compared to over eighty metals, but nonmetals make up most of the crust, atmosphere and oceans of the earth. Bulk tissues of living organisms are composed almost entirely of nonmetals. Most nonmetals are monatomic noble gases or form diatomic molecules in their elemental state, unlike metals which (in complete this table: their elemental state) do not form molecules at all.
Metalloids
A metalloid is a chemical element that has properties that are in between or a mixture of those of metals and nonmetals and is consequently difficult to classify unambiguously as either a metal or a nonmetal. There is no standard definition of a metalloid, nor is there agreement as to which elements are appropriately classified as such. Despite this lack of specificity the term remains in use in chemistry literature.
The six elements commonly recognised as metalloids are boron, silicon, germanium, arsenic, antimony and tellurium. Other elements less commonly recognised as metalloids include carbon, aluminium, selenium, polonium and astatine. On a standard periodic table all of these elements can be found in or near a diagonal region of the p-block, having its main axis anchored by boron at one end and astatine at the other. Some periodic tables include a dividing line between metals and nonmetals and it is generally the elements adjacent to this line or, less frequently, one or more of the elements adjacent to those elements, which are identified as metalloids. Physically, metalloids usually have a metallic appearance but they are brittle and only fair conductors of electricity; chemically, they mostly behave as (weak) nonmetals. They can, however, form alloys with metals. Ordinarily, most of the other physical and chemical properties of metalloids are intermediate in nature.
Table
|
Property |
Typical metal |
Typical non-metal |
|
Conducts electricity |
Yes |
No |
|
Conducts heat |
|
|
|
Dull |
|
|
|
Low melting point |
|
|
|
Malleable |
|
|
|
Ductile |
|
|
Таблица (6 баллов)
|
Свойства |
Tипичный металл |
Tипичный неметалл |
|
Проводит электрический ток |
Да |
Нет |
|
Проводит теплоту |
|
|
|
Тусклый |
|
|
|
Низкая температура плавления |
|
|
|
Пластичность |
|
|
|
Растягивающийся |
|
|
3 этап.
Портретное задание. Кто есть кто? (1 балл за правильный ответ/ 3 балла)
Who is who?(1 mark/ 5 marks)
One of the elements in the Periodic table is named after this famous scientist. Which one?
|
1.E.Rutherford. (rutherfordium № 104 Rf). |
2.D.Mendeleev.(mendelevium № 101 Md) |
|
3.A.Einstein(einsteinium № 99 Es) |
4. Maria Sklodowska-Curie (curium №96 Cm) |
|
5. A.Nobel (nobelium № 102 No) |
|
4 этап.
Опыт (5 баллов). Приложение 3.
Ученики выполняют эксперимент: обнаружить значение рН для следующих растворов: кола, апельсиновый сок, сода, вода, мыло. Ученики выполняют эксперимент и должны объяснить результат:
|
Раствор |
Цвет универсального индикатора |
Значение рН |
Кислотная, щелочная или нейтральная |
|
1 |
|
|
|
|
2 |
|
|
|
|
3 |
|
|
|
|
4 |
|
|
|
|
5 |
|
|
|
Experiment (5 marks)
Testing the pH of different solutions.
Solutions: Cola, orange juice, water, soap, soda, ‘Muster Muscle’. Collect 2cm3 of each solution in separate test-tubes. Add of universal indicator to each solution. Record your results in a table like the one below:
|
Solution |
Colour of universal indicator |
pH number |
Acid, alkali or neutral? |
|
1. |
|
|
|
|
2. |
|
|
|
|
3. |
|
|
|
|
4. |
|
|
|
|
5 |
|
|
|
Which compounds in the table are metal?
What can you say about results for the non-metals compounds?
5 этап.
Кроссворд (1 балл за каждый правильный ответ/ 9 баллов).
The crossword (1 mark / 9 marks). Приложение 4.
Задание: решить кроссворд, используя Периодическую таблицу.
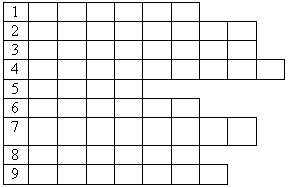
Ответы:
1.Carbon 2.Hydrogen 3. Europium 4.Magnesium 5.Iron
6.Sulfur 7. Titanium 8. Radium 9. Yttrium
6 этап.
Химическая книга рекордов “Гиннес” (1 балл за каждый правильный ответ)
Guinness Book of chemical Records (1 mark)
|
Қазақша |
English |
|
1.Жер бетінде ең көп таралған элемент? Кислород |
The most common element on the Earth is ... Oxygen |
|
2.Ең қиын балқитын металл? Вольфрам |
The strongest metal is ... Francium |
|
3.Ең күшті бейметалл? Фтор |
The strongest non-metal is ... Fluorine |
|
4.Ең қымбат элемент? Калифорний |
The most expensive element is ... Californium |
|
5. Ең жеңіл элемент? Водород- сутек |
The lightest element is ... Hydrogen |
|
6.Ең ауыр металл? Осмий |
The heaviest metal is ... Osmium |
|
7. Ең электрөткізгіш металл? Күміс- серебро |
The best conductor of electricity is ... Silver |
|
8. Ең кең таралған металл? Алюминий |
The most wide spread metal is ... Aluminum |
|
9.Ең иілімді металл? Золото- алтын |
The most of malleable metal is ... Gold |
|
10.Ең улы элемент? Фтор |
The most poisonous element is ... Fluorine |
7 этап.
Тест.
1. Choose the formula of an acidic oxide:
A) Na2O
B) N2O5
C) CaO
D) Al2O3
E) Fe2O3
2.Choose the formula of a base:
A) Na2O
B) KOH
C) CaCO3
D) Al2O3
E) FeS
3. In the solution of an alkali рhenolphthalein changes its to:
A) crimson
B) blue
C) red
D) black
E) whait
4. Choose the formula of a phosphoric acid:
A) HCl
B) HNO3
C) H2CO3
D) HF
E) H3PO4
5. Choose the formula of a magnesium nitrate:
A) MgCl2
B) Mg(NO3)2
C) MnCO3
D) MnF2
E) Mn(NO3)2
6. Choose the formula of the substance which doesn,t belong to the logical group:
A) K
B) Na
C) Ca
D) S
E) Mg
7.Sodium hydrocside reacts with each of two substances:
A) HCl, CuO
B) H2O, Na2O
C) Cu(OH)2
D) H2SO4, CO2
E) MgO, HNO3
8.Define substances: Fe + CuSO4 —> X + Y
X and Y respectively:
A) FeO, CuS
B) FeSO4, CuS
C) FeO, CuSO3
D) FeS, CuO
E) FeSO4, Cu
9. Choose the formula of a carbon dioxide:
A) N2O
B) P2O5
C) CO
D) SO2
E) CO2
10. Possible reaction:
A) KOH + HCl —>
B) NaOH + MgO —>
C) Au + H2S —>
D) CaO + KOH —>
E) CO2 + SO3 —>
Правильный ответ:
1.B 2. B 3.A 4.E 5 B. 6.D 7.D 8.E 9.E 10.A
В конце урока проводятся занимательные опыты. От каждой группы по 1-2 ученику, проводящему этот эксперимент.
Опыты:
1. “Вулкан”.
Для проведения опыта необходимо: чашка Петри, бихромат аммония, магниевая стружка, этанол.
2. “ Горящий платок”.
Для проведения опыта необходимо: хлопчатобумажный платок, чашка с водой, этанол.
3. “ Таинственные надписи”.
Для проведения опыта необходимо: лист бумаги, разбавленная серная кислота, стеклянная палочка, горелка.
Подводятся итоги урока. Выставляются оценки участника каждой группы.
Проводим рефлексию.
Please, write your opinion about the lesson on a sheet of paper.
Write your opinion about the lesson:
It was interesting _____
It was important ________
It was necessary _____
Напишите свое мнение об уроке.
Our lesson is over. Thank you for your work!
Ферменты
С этим классом биологически активных веществ вы встречались не
раз: и в курсе химии 8 класса, когда знакомились с ферментативным катализом, и
в курсе биологии 9 класса, изучая пищеварительные ферменты. Поэтому
их определение вам уже известно. Итак, повторим.
Ферменты, или энзимы, — это органические катализаторы белковой природы, которые
ускоряют реакции, необходимые для функционирования живых организмов.
Так как реакции обмена веществ, протекающие в организмах, можно разделить на
два типа процессов: синтеза (анаболические) л распада (катаболические), то
соответственно можно выделить и два типа ферментов. Примером анаболического
фермента может служить глутаминсинтетаза. Примером катаболического фермента
может служить мальтаза.
Сейчас химикам известно более 2000 ферментов. Все они обладают рядом
специфических свойств, отличающих их от неорганических катализаторов.
Размер молекул. Понятно,
что, будучи по своей природе белками, ферменты должны иметь большие значения
молекулярной массы. Действительно, она может колебаться в пределах от 105 до
107, а это значит, что по своему размеру молекулы ферментов попадают в разряд
коллоидных частиц. Это не позволяет отнести их ни к гомогенным, ни к
гетерогенным катализаторам. Остается отнести их к особому классу катализаторов.
Селективность. Каждый фермент
ускоряет только одну какую-либо реакцию или группу однотипных реакций. Эту их
особенность называют селективностью (избирательностью) действия. Она позволяет
организму быстро и точно выполнить четкую программу синтеза нужных ему
соединений на основе молекул пищевых веществ или продуктов их превращения.
Располагая богатым набором ферментов, клетка разлагает молекулы белков, жиров и
углеводов до небольших фрагментов-мономеров (аминокислот, глицерина и жирных
кислот, моносахаридов соответственно) и из них заново строит белковые и иные
молекулы, которые будут точно соответствовать потребностям данного организма.
Недаром великий русский физиолог, нобелевский лауреат И. П. Павлов назвал
ферменты носителями жизни.
Эффективность. Большинство
ферментов обладает очень высокой эффективностью. Скорость некоторых
ферментативных реакций может быть в 1015 раз больше скорости реакций,
протекающих в их отсутствие. Такая высокая эффективность ферментов объясняется
тем, что их молекулы в процессе «работы» очень быстро восстанавливаются
(регенерируют). Типичная молекула фермента может регенерировать миллионы раз за
минуту, например, широко используемый в сыроделии фермент реннин способен
вызывать коагуляцию (свертывание) белков молока в количествах, в миллионы раз
превышающих его собственную массу. Этот фермент вырабатывается слизистой
оболочкой особого отдела желудка жвачных животных — сычуга.
А вот еще один пример высокой эффективности «работы» фермента, хорошо знакомого
вам из курса химии 8 класса, — катала-зы. За одну секунду при температуре, близкой
к точке замерзания воды, одна молекула этого вещества разлагает около 50 000
молекул пероксида водорода:
каталаза
2Н202----------> 2Н20 + 02
Этот катализатор снижает энергию активации от 75 кДж/моль до 21 кДж/моль. Для
сравнения укажем, что если для ускорения этой реакции применяется платина,
находящаяся в коллоидном состоянии, то энергия активации понижается только до
50 кДж/моль. Что же такое энергия активации? Представим себе смесь бензина и
кислорода. Реакция между этими двумя веществами возможна, но она не пойдет без
затраты некоторого количества энергии, поступившей, например, в форме простой
искры. Вот такая энергия, которая необходима для того, чтобы вещества начали
взаимодействовать между собой, и называется энергией активации. Чем больше
требуемая энергия активации, тем ниже скорость реакции при данной температуре.
Ферменты, действуя как катализаторы, снижают энергию активации, которая
требуется для того, чтобы могла произойти реакция. Они повышают общую скорость
реакции, не изменяя в какой-нибудь значительной степени температуру, при
которой эта реакция протекает. Аналогично «работают» и неорганические
катализаторы, но они уступают в эффективности ферментам.
Зависимость от температуры. Многие ферменты обладают наибольшей
эффективностью при температуре человеческого тела, т. е. приблизительно при 37
°С. Человек погибает при более низких и более высоких температурах не столько
из-за того, что его убила болезнь, а в первую очередь из-за того, что перестают
действовать ферменты, а следовательно, прекращаются обменные процессы, которые
и определяют сам процесс жизни. Неорганические катализаторы сохраняют
активность в более широком интервале температур. Вспомните, например, синтез
аммиака, который проводят при температуре 450—500 °С (катализатор — железо).
Зависимость от среды раствора. Ферменты наиболее эффективно действуют на
субстрат при строго определенной среде раствора, при определенных значениях так
называемого рН. Величина рН, как показано на схеме, характеризует кислотность и
основность растворов и может принимать значения от 1 до 14.

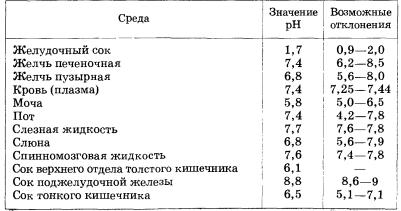
Фермент желудочного сока пепсин наиболее активен при рН 1,5—2
(сильнокислая среда), каталаза крови — при рН 7 (нейтральная среда) и т. д.
Кислотность или основность среды физиологических жидкостей определяет
биологическую активность клеток организма, которая, в свою очередь,
определяется «работой» действующих в них ферментов (табл. 12). Каждая из
физиологических жидкостей имеет определенное значение рН, и отклонение от нормы
может быть причиной тяжелых заболеваний.
Таблица 12. Значения рН физиологических жидкостей
Более подробно с водородным показателем рН вы будете знакомиться
в курсе химии следующего года обучения. Пока же вспомните многочисленные
телевизионные ролики, в которых вовсю эксплуатируется понятие рН (в них его
называют рН-фактор) в рекламных целях.
В контакт с субстратом вступает лишь очень небольшая часть молекулы фермента,
так называемый активный центр. Он включает обычно от 3 до 15 аминокислотных
остатков полипептидной молекулы фермента. Высокая специфичность фермента
обусловлена особой формой его активного центра, которая точно соответствует
форме молекулы вещества катализируемой реакции. Их можно сравнить с «ключом и
замком»: катализируемое вещество выступает в роли «ключа», который точно
подходит к «замку», т. е. к ферменту.
Многие ферменты для проявления активности нуждаются в веществах небелковой
природы — так называемых кофакторах. В роли последних могут выступать ионы металлов (цинка,
марганца, кальция и др.) или молекулы органических соединений; в последнем
случае их называют коферментажи. Иногда для действия фермента бывает необходимо
присутствие как ионов металла, так и коферментов.
В некоторых случаях кофермент очень прочно соединен с белком, например у
каталазы, где кофермент представляет собой комплексное соединение железа с белком
— гемоглобин.
В других ферментах коферменты представляют собой вещества, близкие к витаминам,
которые являются предшественниками коферментов. Например, из витамина Вх
(тиамина) в клетках образуется тиаминпирофосфат — кофермент важного фермента,
входящего в группу декарбоксилаз; из витамина В12 образуются коферменты,
необходимые для усвоения жирных кислот с нечетным числом атомов углерода.
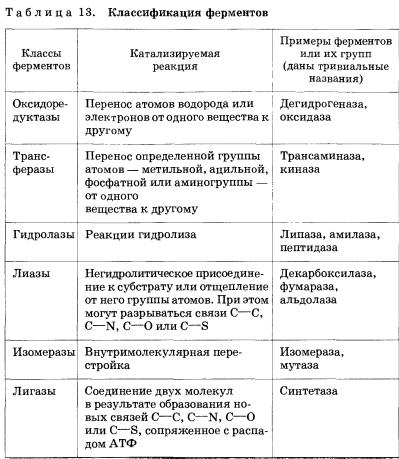
Как же классифицируют ферменты?
В 1961 г. специальной комиссией Международного биохимического союза была
предложена систематическая номенклатура ферментов. Согласно этой номенклатуре
ферменты были поделены на шесть групп в соответствии с общим типом реакции,
которую они катализируют. Каждый фермент при этом получил систематическое
название, точно описывающее катализируемую им реакцию. Однако, поскольку многие
из этих систематических названий оказались очень длинными и сложными, каждому
ферменту было также присвоено и тривиальное, рабочее название, предназначенное
для повседневного употребления. В большинстве случаев оно состоит из названия
вещества, на которое действует фермент, указания на тип катализируемой реакции
и окончания -аза (табл. 13).
Значение ферментов невозможно переоценить. Только в человеческом
организме ежесекундно происходят тысячи и тысячи ферментативных химических
реакций. Вспомним хотя бы те, с которыми вы знакомились на уроках биологии в теме
«Пищеварение». Например, фермент амилаза, который содержится в слюне (его еще
называют птиалином) и в соке тонкого кишечника, помогает превращению крахмала в
мальтозу. Затем мальтоза превращается в глюкозу в тонком кишечнике с помощью
другого фермента — малъ-тазы. В желудке и тонком кишечнике такие ферменты, как
пепсин и трипсин, превращают белки в более простые соединения — пептиды. Затем
эти пептиды превращаются в тонком кишечнике в аминокислоты под действием
ферментов, которые, понятно, называются пептидазами. А вот на жиры (липиды) в
тонком кишечнике действует фермент липаза, расщепляющий их до глицерина и
жирных кислот.
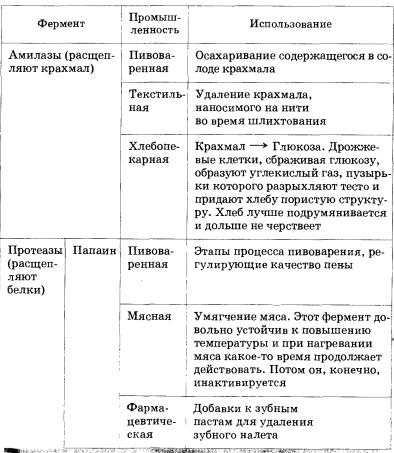
Ферменты играют немаловажную роль и в проведении многих технологических
процессов. Они используются, например, в процессах приготовления пищи, в
производстве пищевых продуктов и напитков, фармацевтических препаратов, моющих
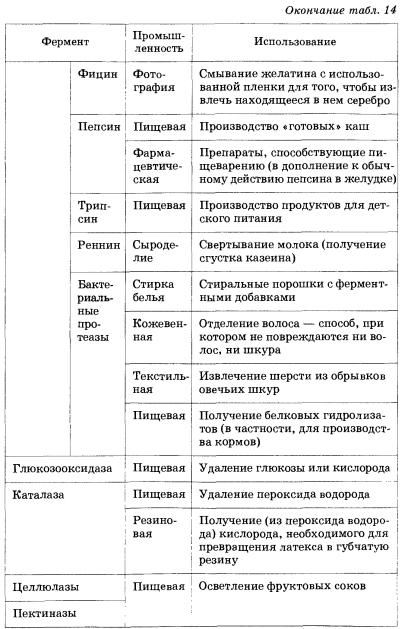
средств, текстиля, кожи и бумаги (табл. 14).
Таблица 14. Некоторые примеры использования ферментов в промышленности
1. Что такое ферменты? Какова их химическая
природа?
2. Чем отличается действие ферментов от действия
неорганических катализаторов?
3. Перечислите факторы, которые влияют на скорость
ферментативной реакции.
4. При какой температуре ферменты проявляют наибольшую
активность: 26 °С, 36 °С, 56 °С?
5. Укажите оптимальное значение рН для действия амилазы и
пепсина.
6. Как классифицируют ферменты и как образуются их
тривиальные названия?
7. Назовите области применения ферментов в промышленности.
8. Лимонную кислоту в промышленности получают при
микробиологическом (ферментативном) брожении раствора глюкозы согласно
уравнению
2С6Н1206 + 302 —> 2С6Н807 + 4Н20
лимонная кислота
Сколько килограммов лимонной кислоты при выходе 62% от теоретически возможного можно
получить из 520 кг 15% -ного раствора глюкозы?
9. Для производства молочной кислоты путем
микробиологического (ферментативного) брожения в промышленности используют крахмал и кормовую патоку. Сколько килограммов
молочной кислоты при выходе 75% от теоретически возможного можно получить из
640 кг кормовой патоки, если массовая доля сухих веществ в ней составляет
80 %, из которых на долю сахарозы приходится 45%?
10*. Скорость реакции ферментативного гидролиза сахарозы не зависит от ее
концентрации и прямо пропорциональна концентрации ферментов. Для
экспериментального определения этой скорости 5 мл раствора сахарозы смешали с
равным объемом раствора фермента и выдерживали при 25 °С в течение 30 мин,
затем туда добавили избыток аммиачного раствора оксида серебра и нагрели.
Выпало 0,27 г осадка. Определите время, необходимое для гидролиза при той же
температуре 50% сахарозы, содержащейся в 4,68 кг ее раствора с плотностью 1,04
г/мл и массовой долей 17,1% после добавления 500 мл такого же раствора ферм
Интегрированный урок химия + английский язык по теме Металлы. 9-й класс
Интегрированный урок «химия + английский язык» по теме «Металлы». 9-й класс
Разделы: Химия, Иностранные языки
Цель: Обобщение знаний о свойствах металлов в условиях двуязычной среды обучения.
Задачи:
Оборудование и вещества: сульфат железа (II), хлорид железа (III), гидроксид натрия, родонит калия, красная кровяная соль, таблица Менделеева, компьютер, проектор, диск с презентацией, раздаточный материал на русском и английском языках.
Ход урока
I. Организационный момент
Учитель: Good morning boys and girls!
At our lesson we’ll speak about metals, their using and we’ll have a short test on RNE (ГИА).
Учитель химии приветствует, ставит цели перед учащимися, знакомит с планом урока.
II. Основная часть урока
1. Актуализация знаний по английскому языку, необходимых для работы на уроке.
Речевая зарядка.
Учитель: We need to revise some words and expressions. Look at the screen, say after me and translate them, please.
На экране – слова. Учащиеся повторяют за учителем слова и выражения в режиме: T-Cl, затем учащиеся работают в режиме: P1, P2, P3, etc. (слайды 4, 5).
2. Общие свойства металлов (слайды 2, 3) Приложение 1
Учитель: Дайте
характеристику элементам-металлам по положению в периодической системе
Д.И.Менделеева.
Учитель: Запишите
у доски строение атомов лития, магния (слайды 4, 5, 6)
3. Химические свойства.
Металлы – восстановители.
Учитель: С какими веществами они могут взаимодействовать?
А) с неметаллами (Слайды 7, 8)
Упражнение 1.
(задание на экране)
Расставьте коэффициенты методом электронного баланса, укажите окислитель и
восстановитель:
Вывод: Ме, стоящие в ряду напряжений левее водорода, вытесняют его из растворов кислот, а стоящие правее – не вытесняют водород из растворов кислот
Упражнение 2.(задание на экране – слайд 14)
Допишите практически осуществимые реакции:
а) Fe + HCl >
б) Ag + H3PO4 >
в) Al + HCl >
г) Zn + Pb(NO3)2 >
д) Fe + MgCl2 >
Проверяем (слайд 15)
а) Fe + 2HCl > FeCl2 + H2^
б) Ag + H3PO4 >
в) 2Al + 3H2SO4 > Al2(SO4)3 + 3H2^
г) Zn + Pb(NO3)2 > Zn(NO3)2 + Pb
д) Fe + MgCl2 >
Учитель: Как взаимодействуют концентрированные серная и азотная кислоты с медью?
У доски 2 учащихся записывают уравнения этих реакций.
4. Экспериментальная задача (2 чел.) (Задание на слайде 18)
1 вариант
Доказать, что выданные вещества содержат ионы железа. Из реактивов имеется
только гидроксид натрия.
2 вариант
Доказать, что выданные вещества содержат ионы железа. Из реактивов имеется
родонит калия.
5. Выполнение теста.
Учащимся розданы листы с заданиями ГИА по химии на английском языке. Учитель английского языка озвучивает задание.
Учитель: It is time to have a test. You have got cards on your desks. Please write down your surnames on them! Let’s read tasks of the test. Учащиеся читают задания в режиме: P1, P2, etc.
Учитель: You should “tick” the letters and in Task 5 you should write a letter according to each number. You have 3 minutes to do it. Let’s start.
Tasks
1. Choose the formula of an acidic oxide.
A. Na2O
B. MnO
C. Mn2O7
D. CuO
2. Sodium hydroxide reacts with each of the two substances:
A. HCl, CuO
B. H2O, Na2O
C. Cu (OH) 2
D. H2 SO4, CO2
Write the equations.
3. Copper reacts with an acid giving H2.
A. is true,
B. is false.
4. Define substances:
X and Y respectively:
A. FeO, CuS
B. FeS, CuO
C. FeSO4, Cu
D. FeO, CuSO3
5. Match formulas and classes of substances.
A. CaCO3
B. BaO
C. SiO2
D. LiOH 1. Basic oxide
2. Alkali
3. Salt
4. Acidic oxide
Учитель: Please give me your cards.
6. Применение металлов.
Учитель: And now let’s see and speak about using metals in our life. There are many spheres where we can use different metals. Let’s look at the screen and say where we can use them.
Работа ведется в режиме: P1, P2, etc. (слайды 20-36)
7. Тест «Улыбка»
1.Формула кислотного оксида:
А) СО2
Б) СаО
В) К2О
2. Продукт взаимодействия оксида натрия с водой
А) соль
Б) щелочь
В) кислота
3. С водой реагирует:
А) СиО
Б) FeО
В) ВаО
4. NаОН взаимодействует с:
А) СиО
Б) P2O5
В) СаО
5. Коэффициент перед формулой кислорода в реакции горения магния:
А) 1
Б) 2
В) 3
8. Употребление названия металлов в литературном наследии: в пословицах и поговорках.
Учитель: We have many proverbs and sayings with metal and water. Let’s read them and give Russian equivalents to all of them. Учащиеся по очереди читают по-английски пословицы и поговорки и переводят их. Работа ведется в режиме: P1, P2, Р3, etc. (слайды 40, 41).
III. Заключительный этап урока
Подведение итогов. Оценки. Домашнее задание
Учитель: Now it is time to finish our lesson. Thank you for your working. You’ve been active in all steps of our lesson. I’m very pleased with your answers. Your marks: Все учащиеся получают оценки за урок. Please write down your homework: to revise all words and expressions on the topic “Metals”.
Учитель: повторить свойства металлов, подготовиться к контрольной работе.
Приложение 2
Список используемой литературы:
· Борунова Е.Б. Химия на английском языке: не навреди // Химия в школе. — 2008. – №7. – С. 35-36.
· Габриелян О.С. Учебник «Химия 9 класс». М.: Дрофа, 2007.
· Горковенко М.Ю. Поурочные разработки по химии, 9 класс. М.: Вако, 2004.
· Евдощенко С.И., Дубчинский В.В., Гайворонская В.В. Словарь химических терминов (с толкованиями, особенностями употребления и английскими эквивалентами) / Под ред. В.В.Дубчинского. – Ростов н/Д:Феникс, 2006.
· Мюррей Ю.В. Большая книга русских пословиц и поговорок и их английских аналогов. – М.: АСТ; СПб.: Сова, 2008. – 252, [4] с.
· Котляр М.М. Как использовать знание иностранного языка при обучении химии // Химия в школе. – 2001. – №3. – С. 48-50.
· Пьянкова Т.М. Практическое пособие по переводу русской научно- технической литературы на английский язык. – М.: Летопись, 1994.
· Шаталов М.А., Кузнецова Н.Е. Обучение химии. Решение интегративных учебных проблем. 8-9 классы: Методическое пособие. – М.: Экзамен, 2006.
· Краткий англо-русский русско-английский словарь-справочник химических терминов с произношением / Под ред. М.М. Кутеповой. – М.: Экзамен, 2006.
· General Xertificate of Secondary Education. Chemistry 2009 /Version 1/ 0 0407/ AQA Great Britain, Nuffield Press Ltd., 2007.
/21.01.2017/Leave a comment
· Черных Наталья Алексеевна, педагог-психолог, социальный педагог
· Чечулина Татьяна Владимировна, учитель химии, экологии
Цель урока: изучение особенностей памяти на примере химического материала.
Задачи:
Продолжительность занятия – 1 час 30 мин.
Занятие проводится для учащихся 8
класса.
Цель: активизация учащихся перед началом занятия.
Учащимся предлагается открыть таблицу Менделеева. Металлы
необходимо
проговаривать, неметаллы – прохлопывать в ладоши. Потом делается наоборот:
неметаллы проговариваются учащимися, металлы – прохлопываются в ладоши.
На плакате посередине написано слово «профессия» и от него
стрелочками в виде лабораторных ножниц нарисованы элементы лабораторного
химического оборудования, куда затем вписываются названные учащимися профессии.
Психолог: Как вы
считаете, людям каких профессий, связанных с химией, важно
иметь хорошую память? (Учащиеся называют: химик, учитель химии, технолог,
лаборант; повар, фармацевт, геолог, эколог, парфюмер и т.д.). Психолог
записывает названные профессии на плакате.
Память –
удивительное свойство человеческого разума. Наши переживания,
впечатления, движения, знания не исчезают бесследно, а сохраняются в памяти.
Она
является своеобразным мостиком между нашим прошлым и нашим будущим. У каждого
человека свои, индивидуальные особенности памяти, например, одни лучше
запоминают услышанную информацию, другие – увиденную. Хорошая память помогает
человеку добиваться успехов в учебе и работе. Но память ржавеет, если ее не
использовать. Чем интенсивнее она используется, тем лучше она функционирует и
развивается.
Происхождение человеческой памяти древние греки связывали с именем
одного из
самых прекрасных героев, созданных человеческой фантазией, с именем Прометея.
Оказывается, этот самоотверженный юноша не только одарил человека огнем. Вот
какие слова вкладывает в его уста великий древнегреческий драматург Эсхил:
Послушайте, что смертным сделал я:
Число им изобрел,
И буквы научил соединять –
Им память дал, мать муз – всего причину.
Таким образом, уже древние греки осознавали, что никакая
деятельность
человека не может осуществляться без памяти. В греческой мифологии существует
богиня памяти – Мнемозина. Считается, что автором этого слова является
Пифагор
Самосский. Скажите. А что произойдет, не будь у нас памяти? (Ученики отвечают.)
Всем известна поговорка «Зарубить на носу», т.е. хорошо запомнить раз
и
навсегда. Слово «нос» в этой поговорке означает не орган обоняния, а памятную
дощечку, бирку для записей. Словом «нос» в древности называли особую дощечку,
которую носили с собой неграмотные люди. На этих дощечках-«носах» и делали с
помощью специальных палочек заметки-зарубки.
Что же такое память? Давайте дадим определение памяти.
Память – это наша
способность запоминать то, что видим, слышим, говорим,
делаем, способность сохранять все это и в нужный момент вспоминать, т. е.
узнавать или воспроизводить то, что знаешь. Запоминание, сохранение, узнавание
и
воспроизведение – вот те главные процессы памяти, которые обеспечивают ее
работу
(психолог обращает внимание учащихся на доску, на которой висит плакат с
нарисованным бревенчатым домиком – памятью). Продуктивность памяти
характеризуется объемом и быстротой запоминания информации, длительностью и
прочностью ее сохранения, точностью воспроизведения.
Тест «Прочность».
Цель: определение
прочности сохранения ранее полученной
информации учащимися.
Учащимся на каждый стол раздаются формулы изученных кислот,
оснований, солей
(Приложение 1).
За одну минуту каждой группе необходимо выбрать из этого списка
либо кислоты, либо основания, либо соли. Учащиеся поочередно называют их.
Ведущий проверяет правильность называемых химических соединений. За каждым
столом подсчитывается число правильно названных химических соединений.
Тест «Воспроизведение».
Цель. Определение воспроизведения информации учащимися.
Учащимся раздаются карточки с таблицей Менделеева с раскрашенными элементами
в ней (Приложение 2). За одну минуту необходимо
запомнить цвета, в которые
окрашены химические элементы таблицы Менделеева. Затем по памяти раскрасить
пустую карточку, далее подсчитать число правильно раскрашенных элементов.
Психолог: В истории человечества
существует множество примеров феноменальной
памяти. Вот некоторые их них:
Понятно, что к этим вершинам могут приблизиться не все, лишь
единицы. Но вот
углубить, расширить, натренировать свою память по силам каждому из нас. Но,
прежде чем работать над своей памятью, необходимо ее изучить.
Существует несколько классификаций видов памяти.
По запоминанию: произвольная и непроизвольная.
Произвольное запоминание происходит с приложением волевых усилий;
непроизвольное – не прилагая никаких усилий, как бы само собой, пример –
реклама.
По содержанию: образная, словесно-логическая, двигательная, эмоциональная.
1. Образная – это
память на то, что мы видим, слышим, нюхаем, пробуем. Она
осуществляется с помощью органов чувств: она может быть слуховая, зрительная,
осязательная, обонятельная, вкусовая.
Тест «Слышу».
Цель. Определение
объема слуховой памяти. Ведущий читает слова:
вещество, элемент, свойство, явление, символ, знак, феррум, силициум, индекс,
коэффициент. Учащимся необходимо записать слова, которые они запомнили, сверить
записи со списком слов, подсчитать число правильных ответов.
Тест «Вижу».
Цель. Определение
объема зрительной памяти. На доске написаны
слова: кислота, углерод, фтор, вода, аллотропия, индикатор, лакмус, основание,
карбонат. Инструкция учащимся: «Прочитайте список слов один раз про себя.
Запишите слова, которые вы запомнили, сверьте записи со списком слов.
Подсчитайте число правильных ответов».
Тест «Осязаю».
Цель. Определение
уровня сформированности тактильной памяти,
припоминания и воображения. Учащийся с завязанными глазами одной рукой на ощупь
должен определить предмет лабораторного оборудования, сопровождая свои выводы
соответствующими комментариями, описывая, что он ощущает (например, холодный на
ощупь, округлой формы с одной стороны и суженой формы, с другой, гладкий –
например, колба).
Память на запахи и на вкус особенно развита у парфюмеров,
дегустаторов.
Давайте вспомним и мы запахи некоторых химических соединений, например,
сероводорода.
2. Словесно-логическая – это память на смысл изложения, выражается в
запоминании и воспроизведении мыслей, понятий, словесных формулировок.
Благодаря
ей человек способен запоминать логику какого-нибудь доказательства, смысл
читаемого текста, смысл событий.
Если процесс запоминания происходит без активного включения
мышления, то
память называется механической.
Тест на логическую и механическую память.
Прочитать 10 пар слов, связанных
логическим смыслом. Затем повторно читаются первые слова, а вторые слова
учащиеся дописывают. То же самое проделывается со второй парой слов, не
связанных логически.
Задание 1. Валентность
– связь; нагревание – температура; водород – газ;
кальций – зубы; уголь – топливо; соляная кислота – желудок; вода-растворитель;
коррозия – металлы; масса – килограмм; железо – металл.
Задание 2. Индикатор –
очки; оксид – тетрадь; йод – кирпич; водород – книга;
молекула – апельсин; железо – целлюлоза; сера – мяч; хлор – утюг; бром –
скрипка; раствор – зонт.
Таким образом, запомнить
пары слов в первом списке значительно проще
именно потому, что они логически связаны. Пары слов во втором списке не имеют
такой связи и поминаются труднее.
3. Двигательная – это память на движения.
Тест.
Учащимся предлагается закрыть глаза и написать на листке формулы
химических элементов: натрия, серной кислоты, воды.
4. Эмоциональная – это
память на переживания. Например, один и тот же
прошедший урок по химии вызывает у разных учащихся разные чувства. Поделитесь,
у
кого какие чувства вызывал урок по химии на прошлой неделе? Учащиеся делятся
воспоминаниями. Различают кратковременную и долговременную память.
Кратковременная память – это запоминание, сохранение информации на
короткий срок
после однократного и очень непродолжительного восприятия – от нескольких секунд
до нескольких минут. В ней может храниться ограниченное количество информации,
в
среднем условно равное семи, что было известно в давние времена. Вспомним семь
чудес света в древнем мире. Цифра семь встречается и во многих русских
пословицах и поговорках.
Тест «Индикатор, среда, окраска».
Учащимся предлагается таблица «Характеристики
самодельных растительных индикаторов» (Приложение 3.
Приложение 4). В течение одной минуты
надо запомнить природный индикатор и окраску индикатора в определенной среде.
Затем на аналогичной таблице дополнить пропущенные ячейки.
Долговременная память – это
длительное сохранение информации, которая часто
запоминается после многократного повторения.
Вспомним первые уроки химии. Что было на первом уроке химии? Поделитесь
воспоминаниями. Учащиеся делятся воспоминаниями.
У памяти есть свои законы:
Как же улучшить память? Единого рецепта не бывает. Поскольку
память каждого
человека уникальна, то у каждого человека существуют свои способы улучшения
памяти. Предлагаю некоторые приемы улучшения памяти. Каждый из вас выберет себе
тот, который лучше подходит для него.
1. Ассоциации – мысленные
связи между образами. Ассоциации должны быть
необычные, нестандартные, невероятные, абсурдные.
Упражнение «Дракон». Для лучшего
запоминания основности кислоты представим
себе дракона – Змея Горыныча: односоставная кислота — с одной головой (один
атом
водорода), двухсоставные – с двумя головами (два атома водорода), трехсоставная
– с тремя головами (три атома водорода).
Упражнение «Кристаллические решетки». Для запоминания типа кристаллических
тел их можно представить различными аналогиями. Учащимся выдаются листы с
аналогиями типов кристаллических тел (Приложение 5).
Аналогия: молекулярного
кристалла – группа супружеских пар; ионного кристалла – романтическая сила
влечения; атомного кристалла – гимнастическая пирамида; структуры металла –
среди пчел.
Существуют приемы запоминания, которыми человек пользуется, не
подозревая,
что эти приемы являются мнемоническими. Так, для запоминания последовательности
цветов в спектре используется прием построения смысловых фраз из начальных букв
запоминаемой информации: «Каждый охотник желает знать, где сидит фазан».
Используем данный прием для запоминания элементов второго периода
таблицы
Менделеева. Например, Люба Белкина была умницей, а Коля Федоров нет (Литий,
Бериллий, Бор, Углерод, Азот, Кислород, Фтор,
Неон).
Упражнение «Веселая таблица». Учащимся предлагается составить фразу для
запоминания элементов третьего периода таблицы Менделеева (Натрий, Магний,
Алюминий, Кремний, Фосфор, Сера, Хлор, Аргон).
Главным в образовании ассоциаций является яркость образа. Чем ярче
образы,
тем больше развито у вас воображение, тем легче создавать связи между ними и
тем
больше информации вы запомните. Например, кислоты могут ходить и разговаривать.
Упражнение «Живые формулы». Учащимся раздаются карточки с различными
химическими элементами. Необходимо из них составить «живые» формулы кислот.
2. Метод мест и фона –
запоминать предметы по их расположению ( в помещении,
по пути следования). Большинство обладателей сверхпамяти признались, что
целенаправленно развивали свои способности, используя метод, известный еще в
Древней Греции и Риме. Его обычно называют « методом Цицерона», «методом
Римской
комнаты», или методом мест. Суть его состоит в том, что «единицы информации»,
которые необходимо запомнить, мысленно расставляются в хорошо знакомой комнате
в
строго определенном порядке. Затем достаточно вспомнить эту комнату, чтобы
воспроизвести необходимую информацию.
Упражнение «Соленый класс». Мысленно расположите предложенные соли в классе
в
определенном порядке. Затем достаточно вспомнить класс, чтобы воспроизвести
данную информацию. Поделитесь своими методами расположения химических
соединений.
3. Прием ритмизации и рифмования. Ритмизация – перевод информации в стихи,
песенки, в строки, связанные определенным ритмом или рифмой. Зарифмованный
учебный материал лучше запоминается.
Чтобы не забыть, каков атомный номер и заряд ядра у разных
химических
элементов и в каком порядке они следуют друг за другом, будем смотреть на
Периодическую систему. Итак, элементы выходят на парад…
В первом периоде, в первом ряду два знаменосца
гордо идут:
У водорода – один электрон, и
возглавляет шествие он.
Гелий богаче. К чему слова, ведь
у него электронов – два.
Второй период – восемь
персон; командует литий,
последний –
неон.
За командиром – бериллий и бор, углерод, азот,
кислород и фтор.
Парад идет по своим законам: растет в ряду число электронов.
Стройной колонною на парад идут элементы за рядом ряд.
Третий период – почти как
второй, любой из восьми – элемент-герой.
За натрием – магний и алюминий, кремний, фосфор,
сера и хлор.
Аргон. А чьи электроны активней? Ясно и так. О чем разговор…
В четвертом периоде рады стараться! – Кавалеристы. Их
восемнадцать.
Рыцари славы, металлы удачи, сверкая доспехами, смело скачут
Калий, кальций, скандий, титан, ванадий,
хром, марганец… Кто атаман?
Триада железа, медь и
другие, и неметаллы – друзья боевые:
Мышьяк, селен и бром.
А криатпон –
на правом фланге, последний он…
Стихотворение зачитывается и раздается учащимся.
Психолог:
Видя этот наш парад, Менделеев был бы рад!
Память нашу оживили, две науки подружили!
Вам приемы показали, памятки на память дали-
Как прочней запомнить, лучше, чтобы не было вам скучно!
В школе химию любите! С психологией дружите!
Свою память улучшайте! Наш урок не забывайте!
«Симон говорит».
Учащимся объясняется, что
они должны следовать инструкциям, которые ведущий начинает словами «Симон
говорит». Если ведущий начинает свои приказания не с этих слов, то следовать
инструкциям не надо. Инструкции следующие: «Симон говорит: «Химия!» – учащимся
надо потереть ладони»; «Симон говорит: «Психология!» – учащимся надо похлопать
в ладоши»; «Симон говорит: «Память!» – руками обхватить голову». Ведущий
ускоряет действия, всегда повторяя в начале фразу «Симон говорит». После
некоторого времени «Симон говорит» опускается. Те учащиеся, которые все-равно
следуют инструкциям, выбывают. Игровой характер упражнения создает
положительно-эмоциональный фон, стимулирует все органы чувств учащихся.
Анкетирование учащихся о прошедшем занятии.
Литература:
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.