
Электрохимия
Электролит ерітінділерінен немесе балқымасынан ток өткенде электр энергиясы химиялық энергияға айналып, электродтар беттерінде тотығу-тотықсыздану процестері жүреді, осы құбылысты электролиздеп атайды.
Катодта (теріс полюсі) тотықсыздану, анодта (оң полюсі) тотығу процесі жүреді. Электрод бетінде жүретін процесс мынандай факторларға тәуелді: зат табиғатына, зат концентрациясына, электрод материалына, электролиз жүретін ортаға (рН), температураға, ток тығыздығына.
Электролиз кезінде ерітіндіден өтетін элект тогының мөлшері мен электродта әрекетке түсетін зат мөлшерінің арасындағы байланыс Фарадей заңдарымен сипатталады.
I заңы.Электролиз кезінде электродта бөлінген заттың массасы электролит арқылы өткен зарядтың мәніне тура пропорционал
![]() (6.14)
(6.14)
мұндағы k – заттың электрохимиялық эквиваленті(электролит арқылы 1Кл заряд өткен кезде бөлініп шыққан заттың массасына тең), I – ток күші, τ – электролиз уақыты.
II заңы. Электр тогының бірдей мөлшерінде (электролит арқылы өткен электр заряды) электролиз кезінде бөлінген заттардың массасы, олардың эквиваленттерінің молярлық массаларына (Мэкв),яғни заттардың молярлы массасының валенттілігі қатынасына пропорционалды болады.
![]()
Барлықэлектролиттерүшінбірдей 1 моль затты бөлуге арналған заряд. Ол F Фарадей саны деп аталады.F=96520 Кл.
Электрохимиялық эквивалент k деп 1 кулон заряд өткенде электродтарда түзілетін зат массасын айтады:
![]() (6.15)
(6.15)
Электролиз кезінде активті және активсіз электродтар қолданылады. Активті анод осы процесс барысында иондарын ерітіндіге беріп ериді, ал активсіздер – электронды тасымалдаушының рөлін атқарады да, химиялық өзгеріске ұшырамайды. Инертті анод ретінде графит және платина қолданылады.
Балқыма электролизі кезінде электродтар маңында бәсекелес бөлшектер (иондар, молекулалар) болмағандықтан катион – катодта, анион – анодта «зарядсызданады». Тұздардың балқымаларын электролиздеу арқылы активті металдар (сілтілік, сілтілік-жер) мен активті бейметалдарды (фтор) алуға болады. Ал, тұздардың ерітіндісін электролиздеу кезінде электрод төңірегінде тұз иондарына су молекулалары және су иондары бәсекелестік етеді. Сондықтан катодтық және анодтық процестердің кейбір заңдылықтарын қарастырайық.
Катодтық процестер. Металл атомы неғұрлым жақсы тотықсыздандырғыш болса, ионы соғұрлым әлсіз тотықтырғыш болады. Сондықтан металдың электрокернеу қатарын иондардың тотықсыздану ретіне қарай шартты түрде үшке бөлуге болады:
1) Катиондардың бірінші тобына электрокернеу қатарында сутектен кейінгі металл иондары жатады, олар сутек иондарынан бұрын тотықсызданады.
2) Катиондардың екінші тобына электрокернеу қатарында марганец пен қорғасынға дейінгі металдарды жатқызуға болады, ол су молекулалары және сутек иондарымен қатар тотықсызданады, металдың ток бойынша шығымы аз.
3) Катиондардың үшінші бөліміне металдардың электрокернеу қатарының басынан алюминийге дейінгі активті металл иондары жатады. Бұл иондар тұздарының ерітіндісін электролиздеген кезде еш өзгеріссіз қалады, оның есесіне су тотықсызданады.
Анодтық процестер. Анодта жүретін тотығу процесі иондардың тотықсыздандырғыш қасиетіне байланысты аниондарды шартты түрде екіге бөлуге болады:
Оттексіз қышқыл қалдық
аниондарды су иондары мен молекуласына қарағанда электрондарын
оңай береді, ал галоген иондарын өзара салыстырсақ,
тотығу мына ретпен жүреді: I-, Br-, Cl-;
Йод ионының тотықсыздандырғыш қасиетінің
жоғары болуы осы қатарда йодқа қарай радиус артады да,
оның электронды ұстап тұру қабілеті азаяды,
сондықтан ол тезірек зарядсызданады. Осы галогендер қатарын
бастайтын фтор ионының тотығуы өте қиын жүреді (![]() ), сондықтан ол оттекті қышқыл
қалдық иондарынан да кейін ерітіндіде өзгеріссіз қалып
қояды. Оның себебі ол элементтер ішіндегі ең электртерістігі
басымы, сондықтан ол өзіне қосқан электроннан
қиын айырылады (тотығады).
), сондықтан ол оттекті қышқыл
қалдық иондарынан да кейін ерітіндіде өзгеріссіз қалып
қояды. Оның себебі ол элементтер ішіндегі ең электртерістігі
басымы, сондықтан ол өзіне қосқан электроннан
қиын айырылады (тотығады).
Оттекті қышқыл қалдық аниондарды су молекуласы анод бетіне қатар келгенде су молекуласы алдымен тотығады.
Электролит ерітіндісінде электр тогы иондар арқылы тасымалданатындықтан олардың электрөткізгіштігі иондардың концентрациясына, қозғалыс жылдамдығына тәуелді. Әр ионға (катионға, анионға) келетін үлесін айтады.
Ион тасымалдау саны деп электролизге жұмсалатын жалпы токтың Тасымалдау саны катион (nк) және анион (nа) тасымалдайтын электр үлесі және мына қатынастар арқылы анықталады:
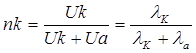 және
және 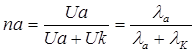 (6.16)
(6.16)
мұндағы nк – катионның тасымалдау саны, nа – анионның тасымалдау саны,
nк + nа = 1
Иондардың тасымалдау сандарының қатынасы олардың қозғалғыштарының қатынасына тең.
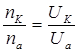
|
Иондардың электродтарда зарядсыздану ретін анықтау |
|||||||||||||||||||||
|
Атомдардың электрон беру қасиеті (тотықсыздандырғыштық қасиеттерінің артуы)
|
|||||||||||||||||||||
Li |
Cs |
K |
Ca |
Na |
Mg |
Al |
Zn |
Fe |
Co |
Ni |
Sn |
Pb |
H |
Cu |
Ag |
Hg |
Au |
Pt |
|||
|
-3.04 |
-3.01 |
-2,92 |
-2,87 |
-2,71 |
-2,37 |
-1.7 |
-0.76 |
-0.44 |
-0.28 |
-0.25 |
-0.14 |
-0.13 |
0 |
+0.34 |
+0.8 |
+0.85 |
+1.5 |
+1.75 |
|||
|
Li+ |
Cs+ |
K+ |
Ca2+ |
Na+ |
Mg2+ |
Al3+ |
Zn2+ |
Fe2+ |
Co2+ |
Ni2+ |
Sn2+ |
Pb2+ |
H+ |
Cu2+ |
Ag+ |
Hg2+ |
Au3+ |
Pt4+ |
|||
|
Иондардың электронды қосу қасиеті (тотықтырғыштық қасиеттердің артуы)
|
|||||||||||||||||||||
|
S2-, I-, Br-, Cl-, OH-, SO42-, NO3-, CO32-, PO43-, MnO4-, F-
Тотығу қасиеті кемиді (анодта зарядсыздануы)
|
|||||||||||||||||||||
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.