
Дата проведения__________
Класс 11 а
Матиев З.С.
Урок по теме «Химические свойства хрома, меди и их соединений».
Цели урока:
Общеобразовательные:
- через систему познавательных задач расширить и углубить знания учащихся о переходных элементах;
- используя частично-поисковый, творческий подход к обучению, направлять поисковую деятельность учащихся на установление взаимосвязи между строением и свойствами хрома, его применением;
- уметь записывать уравнения химических реакций, характеризующих химические свойства соединений хрома в окислительно-восстановительном виде;
-нахождение в природе;
Развивающие:
формировать умения сравнивать. Вычленять в изученном существенное, устанавливать. Причинно - следственные связи, делать обобщения, связно излагать и доказывать учебный материал, применять и систематизировать полученные знания.
Воспитывающие
Воспитывать умение работать в атмосфере поиска, творчества, прививать чувство ответственности за выполненную работу, самостоятельность, общительность, коммуникабельность.
Задачи:
- через систему познавательных задач расширить и углубить знания учащихся о соединениях переходных элементах;
- формирование ключевых компетенций (искать, изучать, думать, анализировать, критически оценивать информацию, адаптироваться).
- развитие коммуникативных качеств личности, дисциплины учебного труда, ответственность за результаты своего труда.
Оборудование: Мультимедийное оборудование (проектор, компьютер, экран).
Планируемые результаты обучения:
Предметные:
· продолжить формировать систему предметных знаний;
· сформировать умение характеризовать переходный элемент хром и его соединения;
· овладение терминологией;
· сформировать способность применять знания для практических задач.
Метапредметные:
· научить планировать собственную деятельность;
· научить осуществлять контроль и оценку своей деятельности.
Личностные:
· сформировать устойчивый интерес к поиску решения проблемы;
· саморазвитие и самосовершенствование.
Ход урока
I. Изучение нового материала.
Вопросы для учащихся: а) Какие степени окисления характерны для хрома?
б) Предложите формулы соответствующих оксидов.
Характеризуются все оксиды хрома по плану.
План характеристики
1. Физические свойства
2. Характер
3. Получение
4. Химические свойства
Хром
Электронная конфигурация
Хром находится в IV группе побочной подгруппе и имеет следующее электронное строение:
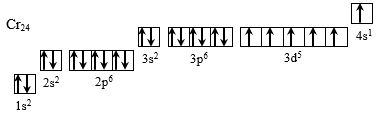
Рисунок 4 – Электронная конфигурация атома хрома
Так как для атома хрома энергетически более выгодно иметь наполовину заполненную 3d-орбиталь, у него, как и у меди, наблюдается проскок электрона, что позволяет ему находиться в степенях окисления от +1 до +6, но наиболее устойчивыми являются +2, +3, +6.
Физические свойства
Хром обладает следующими физическими свойствами:
Таблица 4 – Основные физические свойства хрома
|
Свойство |
Значение |
|
Цвет |
Серебристо-белый с металлическим блеском |
|
Структура |
Твердый |
|
Температура плавления, °С |
1890 |
Нахождение в природе
В природе большая часть хрома заключена в составе хромистого железняка Fe(CrO2)2. Иногда может встречаться в виде оксида хрома (III) и других соединениях.
Способы получения хрома
Из хромистого железняка путем восстановлением углем при высоких температурах получают смесь железа и хрома – феррохром:
FeO + Cr2O3 + 3C = Fe + 2Cr + 3CO↑
Для получения чистого хрома проводят восстановление оксида хрома (III) алюминием:
Cr2O3 + 2Al = 2Cr + Al2O3
Химические свойства
Как и все вышеописанные металлы, хром покрыт оксидной плёнкой, которую трудно растворить даже сильными кислотами. Благодаря ней он обладает высокой стойкости к коррозии, поэтому начинает реагировать с разбавленными растворами кислот лишь спустя время. Концентрированные кислоты, такие как HNO3 и H2SO4, пассивируют оксидную пленку (укрепляют ее).
Применение
Благодаря своей коррозионной стойкости, хром используют в качестве защитных покрытий (хромируют поверхности металлов и сплавов). Также используется для создания легированных сталей, речь о которых пойдет в следующем уроке.
Медь
Электронная конфигурация
Медь является металлом, расположенным в I группе побочной подгруппе и имеет следующую электронную конфигурацию:
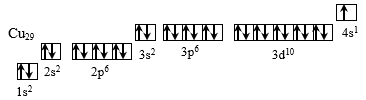
1s2
Рисунок 1 – Электронная конфигурация атома меди
Мы видим, что у меди наблюдается проскок электрона – отступление от общей для большинства элементов последовательности заполнения электронных оболочек. По принципу наименьшей энергии электронные орбитали должны заполняться в следующем порядке:
1s → 2s → 2p → 3s → 3p → 4s → 3d …
Но для некоторых атомов энергетически более выгодно иметь наполовину (5 электронов, дальше увидим у хрома) или полностью заполненную (10 электронов, как у меди) 3d-орбиталь.
Медь имеет две валентности: 1 и 2 и проявляет степени окисления +1 и +2.
Физические свойства
Медь обладает следующими физическими свойствами
Таблица 1 – Основные физические свойства меди
|
Свойство |
Значение |
|
Цвет |
Светло-розовый |
|
Структура |
Тягучая, вязкая, легко прокатывается |
|
Температура плавления, °С |
1083 |
Нахождение в природе
В природе медь встречается в самородном виде, а также в составе некоторых минералов:
Способы получения меди
Основными способами получения меди являются:
Cu2O + С = 2Сu + CO
Cu2O + CO = 2Cu + CO2
Химические свойства
При комнатной температуре медь не вступает в реакции с большинством соединений. При повышенной температуре ее реакционная способность резко возрастает.
Реакции с простыми веществами:
2Cu + O2 = 2CuO
2Cu + Cl2 = 2CuCl2
Cu + S = CuS
Реакции со сложными веществами:
Cu + 2H2SO4(конц) = CuSO4 + SO2↑ +2H2O
Cu + 4HNO3(конц) = Cu(NO3)2 + 2NO2↑ + 2H2O
3Cu + 8HNO3(разб) = 3Cu(NO3)2 + 2NO↑ + 4H2O
Применение
Широкое применение находит как сама медь, так и её соединения. В чистом виде она используется для производства проводов, кабелей, теплообменных аппаратов, а также входит в состав многих сплавов.
Соединения меди, например, медный купорос CuSO4∙5H2O используется для защиты растений, а гидроксид меди является качественным реагентом для определения альдегидной группы у органических соединений, а также наличия глицерина (дает голубое окрашивание раствора).
III. Закрепление новой темы.
Cr2O3-----Cr-----CrCI2-----CrCI3------Cr(OH)3------Na3[Сr(OH)6]------Cr(NO3)3
IV. Домашнее задание
П. 68 стр.309-317 упр. 4(б), 7.
V. Рефлексия.
В завершении урока ответьте (устно) на некоторые вопросы:
Мы узнали______________________________________
Мы умеем ______________________________
ПРИМЕРЫ И РАЗБОР РЕШЕНИЙ ЗАДАЧ ТРЕНИРОВОЧНОГО МОДУЛЯ
1. Решение задачи на вычисление количества исходного реагента.
Условие задачи: При растворении меди в растворе концентрированной азотной кислоты выделилось 2 л газа. Вычислите массу прореагировавшей меди.
Шаг первый. Напишем уравнение реакции и определим, какой газ выделился, расставим коэффициенты.
Cu + 4HNO3(конц) = Cu(NO3)2 + 2NO2↑ + 2H2O
Шаг второй. Вычислим количество вещества газа:
![]()
Шаг третий. Вычислим количество вещества меди:
По уравнению реакции: n(Cu) = 0,5n(NO2), тогда
n(Cu) = 0,5 ∙ 0,089 = 0,044 (моль)
Шаг четвёртый. Вычислим массу меди:
m(Cu) = 0,044 ∙ 46 = 2,024 (г)
Ответ: 2,024 (г).
1. Решение задачи на выход продукта.
Условия задачи: при обжиге 8,515 г сульфида цинка с последующим восстановлением оксида с помощью угля выделилось 3,45 л газа. Рассчитайте выход реакции обжига, если выход реакции восстановления равен 60%.
Шаг первый. Запишем уравнения реакций и вычислим молярные массы компонентов:
ZnS + O2 = ZnO + SO2↑
ZnO + C = Zn + CO↑
M (ZnO) = 81 г/моль
Шаг второй. Вычислим количество вещества газа:
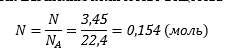
Шаг третий. Вычислим массу оксида цинка:
Так как выход реакции составил 60%, то
n (ZnO) = 0,6n (CO) = 0,6 ∙ 0,154 = 0,0924 (моль)
Шаг четвёртый. Вычислим массу оксида цинка:

Шаг пятый. Вычислим выход реакции:
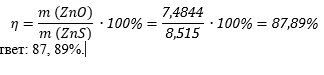
Ответ: 87, 89%.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.