
Химиялық термодинамика.
1 Термодинамика пәні. Термодинамиканың негізгі ұғымдары
Термодинамика ғылыми пән болып табылады және зерттейді:
1) Энергияның бір түрден басқа түрге, жүйенің бір бөлігінен басқасына ауысуын;
2) Әртүрлі физикалық және химиялық процестерді сүйемелдейтін энергетикалық әсерлерді, олардың процестің жүру жағдайынан тәуелділігін;
3) Қарастырылған жағдайда процестің өздігінен өту шегін, бағытын, мүмкіндігін. Термодинамика негізгі екі заңға, яғни термодинамиканың бірінші және екінші бастамасына негізделген.
Термодинамиканың зерттейтін негізгі нысаны жүйе.
Жүйе деп, қоршаған ортадан ойша немесе шын мәнінде оқшауланған жеке немесе топталған денелер жиынтығын айтады.
Қоршаған орта дегеніміз жүйемен тура немесежанамабайланыстаболатынныңбарлығы. Қоршағанортаменәрекеттесусипатынаорайтермодинамикалықжүйелердіңашық, жабықжәнеоқшауланғантүрлеріболады.
Ашықжүйедеп, қоршағанортаменэнергиясымен де, затымен де алмасаалатынжүйеніайтамыз.
Жабықжүйедеп, қоршағанортамензатыменалмасуыжоқ, бірақэнергиясымен, жұмысыменалмасаалатынжүйеніайтамыз.
Оқшауланғанжүйедеп, сыртқыортамензатымен де, энергиясымен де алмасуыжоқжүйеніайтамыз.
Сондай-ақжүйебіртектінемесегомогендіболады, ішіндебөлубеттеріжоқ. Мысалы, кез-келгензаттыңертіндісінемесежабықыдыстағы газ. Әртектінемесегетерогендіжүйе, бөлубеттері бар. Мысалы, қаныққанертіндідегітұздыңкристалдары.
Жүйеніңбарлықфизикалықжәнехимиялыққасиеттерініңжиынтығынжүйеніңкүйідейді. Жүйеніңкүйітермодинамикалықпараметрлермен(температура, қысым, көлем, концентрация)сипатталады. Параметрлерекігебөлінеді. Жүйеніңөлшемінентәуелдіпараметрлер(көлем, масса, энтропия) экстенсивтідеп, ал жүйеөлшемінентәуелсіз(температура, қысым, потенциал) интенсивтідепаталады.
Термодинамикалықпараметрлердіңбіреуініңөзгеріменбайланыстыболатынжүйедегікез-келгенөзгерістітермодинамикалық процессдейді. Тікелейөлшенетінпараметрлерді(температура, қысым, көлем, концентрация) жүйенің негізгі күй парметрлері деп атайды. Тікелей өлшенуге келмейтін күй параметрлерін (ішкі энергия, энтальпия, энтропия, термодинамикалық потенциал) жүйенің күйфункциясы дейді.
Ішкі энергия (U) жүйенің жалпы энергия қорын сипаттайды. Ол жүйені құрайтын бөлшектердің қозғалыс және әрекеттесу энергияларының барлық түрін: молекулалық қозғалыстың кинетикалық энергиясын, бөлшектердің молекулааралық тартылу және тебісу энергиясын, молеклаішілік немесе химиялық энергиясын, электрондық қозу энергиясын, ядроішілік және сәулелік энергияны құрайды. Ішкі энергия өзгерісі (ΔU) бастапқы ( U1) және соңғы күйдегі (U2) жүйенің ішкі энергия өлшемдер айырмашылығмен көрсетіледі:
![]() (2.1)
(2.1)
Энергияның сақталу заңына сәйкес әр оқшауланған жүйеде барлық энергияның алгебралық мәні 0-ге тең. ∆U=0.
Энтальпия (Н) – ол жүйе тұрақты қысымда ие болатын және сандық жағынан ішкі энергия U мен потенциалдық энергия pV қосындысына тең энергия:
![]() (2.2)
(2.2)
p – қысым, V– жүйенің көлемі. Энтальпия терминін 1909 жылы Оннес енгізген, ол гректің эн – ішкі, тальпэ – жылу деген сөздері.
Термодинамиканың І заңы – энергияның сақталуы заңы болып табылады. Энергия сақталу заңы келесідей тұжырымдалады: табиғаттың барлық құбылыстарында энергия жоғалмайды, жоқтан пайда болмайды, тек қатаң эквивалентті қатынаста бір түрден екінші түрге ауысады.
Термодинамика энергияның жұмысқа және жылуға айналуының екі түрін қарастырады. Сол себепті термодинамиканың І заңы жылу энергиясының жұмысқа қатынасын қарастырады. Жүйесінің жалпы энергия өзгеруі мынадай теңдеумен көрсетіледі:
∆U=U2–U1
Ішкі энергия кей жағдайда артып, кей жағдайда төмендейді. Осыған сәйкес ішкі энергия (∆U) өзгерісі оң немесе теріс белгімен белгіленеді.
Термодинамиканың І заңының бірнеше анықтамасы бар, бірақ олардың барлығы бір мағынаны білдіреді: өзінің әр түрлі түрлерінің бір-біріне қайтымды ауысуындағы энергия эквиваленті және жоғалмайды.
Оқшауланған жүйедегі энергияның барлық түрлерінің мәні тұрақты.
І ретті тұрақты двигатель жасау мүмкін емес, себебі тыс энергияны жұмысқа айналдыра алатын машина жасауға болмағандықтан.
Термодинамиканың бірінші заңы немесе бірінші бастамасы негізінен энергияның сақталу заңы болып есептеледі.
Жүйе күйінің соңғы өзгерісі үшін термодинамиканың бірінші заңы келесідей теңдеумен көрсетіледі:
![]() немесе
немесе ![]() (2.3)
(2.3)
мұндағы![]() – жүйеге берілген немесе
жүйеден шығарылған жылу
– жүйеге берілген немесе
жүйеден шығарылған жылу
![]() –ішкі энергия өзгерісі
–ішкі энергия өзгерісі
![]() – жүйемен істелген
жалпы жұмыс
– жүйемен істелген
жалпы жұмыс
Егер жүйедегі шексіз аз өзгеріске ұшырауында онда термодинамиканың І заңын келесі түрде жазуға болады:
δQ=dU+δA (2.4)
мұндағы δQ – шексіз аз жүйемен сіңірілетін жылу мөлшері
dU – ішкі энергия жүйесінің шексіз аз өсуі
δA – сол процессте жүйеде істелетін шексіз аз жұмысы
Бұл теңдеу термодинамиканың 1-ші заңының математикалық өрнегі болып табылады. Жүйеге берілген немесе жүйеден шығарылған жылу мөлшері ішкі энергияның өзгерісіне және жұмыс жасауға кетеді.
Әртүрлі термодинамикалық процестер үшін термодинамиканың 1-ші заңының математикалық теңдеуі келесідей түрде жазылады.
Изобаралық процесс ( p = сonst )
![]()
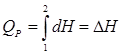 ;
; ![]() (2.5)
(2.5)
Изобаралық процесте жылу мөлшері энтальпияның өзгеру шегі болып табылады.
Изохоралық процесс(V= сonst)
![]()
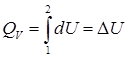 ;
; ![]() (2.6)
(2.6)
Жүйеге берілген жылу мөлшері ішкі энергия өзгерісіне жұмсалады. Бұл процесте ешбір жұмыс жүргізілуі мүмкін емес.
Изотермиялық процесс (Т = сonst)
![]()
![]() (2.7)
(2.7)
Жүйеге тиісті жылу толығымен ұлғаю жұмысына айналады. 1 моль газ үшін pV=RTболғанда, теңдеу келесідей түрде болады:
![]()
![]()
![]() R=const, RT=const, p1V1=
p2V2
R=const, RT=const, p1V1=
p2V2
![]() (2.8)
(2.8)
![]() (2.9)
(2.9)
Изотермиялық процесте газдың ұлғаю жұмысы тек көлем мен қысымның кері пропорционалдық жағдайындағы өзгеруіне тәуелді және ол жұмыс жүйеге сырттан енгізілген жылу есебінен жүреді.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.