
Публикация является частью публикации:
Тема: Кислород.
Цель: Формирование понятий «Химический элемент», «Простое вещество».
Задачи образования:
Обеспечить в ходе урока усвоение свойств кислорода. Продолжить формирование умений и навыков составления уравнений химических реакций, характеризующих свойства кислорода. Актуализировать понятие «окисление», «оксиды».ввести понятия – термохимическое уравнение, тепловой эффект. Формирование умений и навыков решение расчетных задач.
Задачи развития:
Продолжить формирование общеучебных умений и навыков работы с текстом (анализ тезиса, формулировка узловых моментов и выводов, преобразование текста). Продолжить формирование умения выделять главное, существенное в свойствах неорганических веществ.
Развивать самостоятельность в учении через организацию теоретического исследования, дискуссию и специально организованную работу с текстом.
Развивать познавательный интерес через использование данных о применении изучаемых явлений.
Задачи воспитания:
Содействовать формированию представлений о причинно-следственных связях (взаимозависимость строения и свойств, применения).
Формирование навыков и умений коллективного взаимодействия.
Оборудование: Видеоопыты(или оборудование для демонстрационных опытов - горения угля, серы, фосфора на усмотрение педагога и при наличии дополнительного времени на изучение темы), учебный текст (Приложение 1), карточки с формулами веществ С, S, P, Li, Na, Fe, N2, О2 , СО, С6Н12О6 , NaNO3 , а также – 402 кДж, 10%(Приложение 2) для оперативной организации работы с учащимися (запись уравнения реакции, решение задачи теми учащимися у которых на столе лежит соответствующая карточка).
Структура и основное содержание урока
I. Организационно-мотивационная часть урока
- Фронтальная беседа с учащимися об изучаемой теме(что знаем о кислороде как об элементе, что такое кислород - вещество).
- постановка цели и задач урока
- Порядок работы, структура деятельности.
II. Операционно-деятельностный этап
(Чтение тезиса и выделение узловых моментов, содержательный анализ, дискуссия, работа с текстом учебника, составление уравнений, решение задач выводы.)
Технологическая карта урока
|
№ |
Чтение тезиса и выделение узловых моментов |
Содержание совместной деятельности (анализ узловых моментов).содержание дискуссии |
Озаглавить тезис, сделать вывод. Результат.
|
|
1. |
Доля кислорода в воздухе на протяжении многих геологических лет постоянна. Атмосфера – источник кислорода В сутки человек потребляет 430 г кислорода. Один гектар леса вырабатывает за час столько кислорода, сколько нужно для дыхания двухсот человек. Какую массу кислорода выделяет гектар леса за один час? |
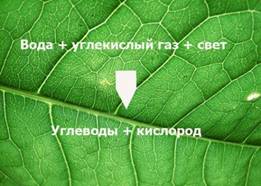
Постоянные и переменные составляющие части воздуха(§15 с. 91). Объёмная и массовая доля кислорода в воздухе. Сущность и уравнение фотосинтеза. |
Охрана воздуха. Состав. Линейна диаграмма. задачи |
|
2. |
В жидком состоянии воздух голубого цвета. Температура кипения жидкого кислорода: -183°С, азота: -106°С. Сколько литров(кг) кислорода можно получить из 100 л (100кг)воздуха. |
Как воздух сделать жидким. Какой газ будет улетучиваться первым. |
Получение кислорода из воздуха (перегонка жидкого воздуха). Решение задачи. |
|
3. |
Кислород взаимодействует почти со всеми простыми веществами. |
Работа с учебником. Чтение второго абзаца(стр. 123), уравнения, тип реакции. Формулировка тезиса. Самый сильный окислитель. Ряд электроотрицательности. Демонстрация видеоопытов или демонстрационных опытов: горение фосфора, железа в кислороде. |
Взаимодействие с простыми веществами. Формулировка тезиса. Запись уравнений. Окислитель, восстановитель, количество и переход электронов. Исключения. |
|
4. |
Практически все реакции с кислородом – экзотермические. Так при сжигании 1 моль углерода выделяется 402 кДж теплоты. |
Экзо,- эндотермические реакции. Тепловой эффект реакции. Горение. Уголь и углерод. Причина эндотермичности взаимодействия азота с кислородом. |
Термохимические уравнения. Решение задачи Реакция соединения азота с кислородом – эндотермическая. |
|
5. |
Зная тепловой эффект реакции можно рассчитать количество выделившейся теплоты. Сколько выделится теплоты, если сжечь 36 г чистого углерода и 90 г угля содержащего 10 % примесей. |
Экзотермическая реакция Тепловой эффект |
Экзотермическая реакция Тепловой эффект реакции Расчеты по термохимическому уравнению |
|
6. |
При горении сложных веществ образуются продукты полного или неполного окисления. |
Полное и неполное окисление углерода. Причины. Признаки |
Значение, применение в быту(угарный газ), промышленности. |
|
7. |
Один из первооткрывателей кислорода К. Шееле получил его при нагревании силитры(нитрата натрия). Какой объём кислорода (н.у.) он получил, если для реакции взял 8,5 г этой соли и достаточно ли будет полученного кислорода для сжигания 24 г угля,. |
Формулы, уравнение, тип реакции. Способ решения задачи |
История открытия. Получение в лаборатории решения решение задачи |
III. Рефлексивно оценочный этап.
1. Вывод относительно поставленной цели( что узнали нового).
2. Обобщение полученных знаний в виде схемы(«Паук»,
3. Вывод относительно способа работы( что оказалось полезным).
IV. ДЗ: дополнить лучи в схеме Получение в лаборатории(абзац 2, стр. 127, §21).
Сформулировать тезис о получении кислорода в лаборатории.. Преобразование (уравнения); Применение.
Упр.4, Круговорот кислорода- пересказ.
|
С |
N2 |
|
P |
О2 |
|
S |
СО |
|
Li |
Fe |
|
Na |
Н2S |
|
10% |
О2 |
|
402 кДж |
|
|
NaNO3 |
|
|
С6Н12О6 |
|

1. 
 Доля кислорода в воздухе на
протяжении многих геологических лет постоянна. Атмосфера – источник кислорода.
В сутки человек потребляет 430 г кислорода. Один гектар леса вырабатывает за
час столько кислорода, сколько нужно для дыхания двухсот человек. Какую массу
кислорода выделяет гектар леса за один час?
Доля кислорода в воздухе на
протяжении многих геологических лет постоянна. Атмосфера – источник кислорода.
В сутки человек потребляет 430 г кислорода. Один гектар леса вырабатывает за
час столько кислорода, сколько нужно для дыхания двухсот человек. Какую массу
кислорода выделяет гектар леса за один час?
2.
 В жидком состоянии
воздух голубого цвета. Температура кипения жидкого кислорода: -183°С, азота:
-106°С. Сколько литров(кг) кислорода можно получить из 100 л (100кг)воздуха.
В жидком состоянии
воздух голубого цвета. Температура кипения жидкого кислорода: -183°С, азота:
-106°С. Сколько литров(кг) кислорода можно получить из 100 л (100кг)воздуха.
3. Кислород взаимодействует почти со всеми простыми веществами.
4. При сжигании 1 моль углерода выделяется 410 кДж тепла. Сколько теплоты выделится при полном сжигании 24 г углерода.
5. Практически все реакции с кислородом – экзотермические. Зная тепловой эффект реакции можно рассчитать количество выделившейся теплоты. Сколько выделится теплоты, если сжечь 36 г чистого углерода, или 90 г угля содержащего 10 % примесей
6. При горении простых и сложных веществ образуются продукты полного или неполного окисления.
7.
 Один из первооткрывателей кислорода К. Шееле получил его
при нагревании селитры(нитрата натрия). Какой объём кислорода (н.у.) он
получил, если для реакции взял 8,5 г этой соли. Достаточно ли будет полученного
кислорода для сжигания 3,2 г серы, содержащего 10% примесей.
Один из первооткрывателей кислорода К. Шееле получил его
при нагревании селитры(нитрата натрия). Какой объём кислорода (н.у.) он
получил, если для реакции взял 8,5 г этой соли. Достаточно ли будет полученного
кислорода для сжигания 3,2 г серы, содержащего 10% примесей.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.