
Дагестанский институт повышения квалификации педагогических кадров
Проект
Реализация требований ФГОС при изучении темы:
«Неметаллы»
Выполнил: учитель химии ГКОУ ЦОДОУ ЗОЖ
«Щедринская СОШ» Тляратинского района
Магомедова Муъминат Гаджиевна
Махачкала 2015 г.
Содержание
Аннотация…………………………………………………………………………3
Введение: модернизация российского образования. ФГОС, его назначение…4
Основная часть…………………………………………………………………….8
1.Изучение материалов ФГОС и разработка плана действии по реализации программ ………………………………………………………………………10
2.Практическое применение материалов ФГОС на уроках химии………
2.1 Тематическое планирование темы по урокам…………………..9
2.2 Поурочное планирование по теме «Неметаллы»………………21
2.3 Итоговая контрольная работа по теме…………………………………38
3.Рекомендация………………………………………………………………40
4.Заключение……………………………………………………………….41
Список использованной литературы……………………………………...42
Аннотация
В работе приведен подробный план по реализации требований ФГС по теме «Неметаллы», согласно учебнику О.С Габриеляна Химия для 9-х классов.
Целью проекта является - составление плана работы по внедрению требований ФГОС к урокам химии, на примере темы «Неметаллы»
Задачи:
1.Изучить нормативные документы касающихся требований ФГОС и учебно-методическую литературу, раскрывающую содержание нормативных документов.
2.Отобрать приемы, методы, средства, развивающие универсальные учебные действия на уроке химии в 9-ом классе по теме «Неметаллы»
3. Составить конспект уроков по химии для 9-го класса по теме «Неметаллы».
Данная тема объясняется в 9 классе в рамках курса химии. Работа состоит из введения, основной части, заключения и списка использованной литературы. Во введении приводится информация о модернизации Российского образования, согласно ФГОС. В основной части приведены цели, задачи, планирование темы по урокам, а так же подробно изложен ход урока.
ВВЕДЕНИЕ: модернизация российского образования.
ФГОС, его назначение.
Реализация новых стандартов на всех ступенях общего и профессионального образования требует соответствующей подготовки руководящих и педагогических кадров, как в системе высшего профессионального образования, так и в системе дополнительного профессионального педагогического образования: педагоги должны овладеть компетенциями, необходимыми для реализации ФГОС.
Федеральные государственные образовательные стандарты общего образования отражают понимание научно-педагогическим сообществом вызовов, возникших перед отечественной системой образования в условиях её интеграции в мировое образовательное пространство. На современном этапе информационной революции в значительной степени изменились требования к образованному человеку. Сегодня ему невозможно знать всё о достижениях в естественных и гуманитарных науках, но очень важно научиться применять свои знания в конкретных жизненных ситуациях. В XXI в. актуальным становится формирование личностной готовности и способности к непрерывному образованию, формированию компетенций, востребованных на рынке труда. В условиях повышения мобильности, развития миграционных процессов все более значимым становится воспитание российской гражданской идентичности молодых россиян, выпускников общеобразовательных учреждений. В связи с формированием современной насыщенной информационно-образовательной среды не менее важно обеспечить переход к новой образовательной парадигме системно-деятельного процесса обучения. Стандарты общего образования первого поколения, регламентирующие содержание образования в дидактических единицах, соответствовали классической образовательной парадигме конца XX в. В начале XXI в. они перестали выполнять функцию педагогической поддержки развития образовательного пространства. Осознание экспертным научно-педагогическим сообществом потребности в новых инструментах развития образовательного пространства России в XXI в. привело к разработке новых образовательных стандартов. Принципиальным отличием государственных образовательных стандартов второго поколения является усиление их ориентации на результаты образования как системообразующий компонент конструкции стандартов. В новых стандартах объектом стандартизации стало не содержание образования, ориентированное на достижение относительно частных предметных образовательных результатов, а система требований к образовательным результатам: личностным, метапредметным, предметным. Стандарт общего образования второго поколения представляет совокупность требований, обязательных при реализации основной образовательной программы основного общего образования образовательными учреждениями, имеющими государственную аккредитацию. В соответствии с новым методологическим подходом изменились структура и содержание стандартов. Основными документами, составляющими нормативный пакет ФГОС, выступают требования к результатам, структуре и условиям освоения основной образовательной программы основного общего образования. В сочетании с документами инструктивно-методического и рекомендательного характера они образуют систему всестороннего и разно уровневого сопровождения стандартов (нормативное, методологическое, инструментальное, технологическое, информационно-методическое). Стандарты второго поколения адресованы широкому кругу пользователей и поэтому изложены доступным языком. За рамками содержания стандартов остались вопросы, имеющие сугубо профессиональное, прикладное значение, в том числе для руководящих и педагогических кадров ОУ. Указывая на необходимость создания системы методического сопровождения деятельности педагогов, на всех этапах реализации требований ФГОС, новые образовательные стандарты ставят перед системой ИПК задачу обеспечения адекватности системы непрерывного педагогического образования происходящим изменениям в системе образования в целом. При этом в основополагающих документах, обеспечивающих реализацию ФГОС, подчеркивается, что темпы модернизации подготовки и переподготовки педагогических кадров должны опережать темпы модернизации системы образования.
Химия как предмет образовательной системы не исключение. По этому при реализации ФГОС необходимо выработать план действий по модернизации преподавания химии в рамках учебной программы.
Целью работы является изучение нормативных документов, касающихся требований ФГОС к урокам химии, а также реализация этих требований на примере темы «Неметаллы»
Задачи:
1.Изучить нормативные документы касающихся требований ФГОС и учебно-методическую литературу, раскрывающую содержание нормативных документов.
2.Отобрать приемы, методы, средства, развивающие универсальные учебные действия на уроке химии в 9-ом классе по теме «Неметаллы»
3. Составить конспект уроков по химии для 9-го класса по теме «Неметаллы».
Время реализации проекта.
26 часов
Возраст участников проекта
9 класс (14-15 лет)
Планируемые результаты изучения предмета
По окончанию курса учащиеся должны научится:
· описывать свойства твёрдых, жидких, газообразных веществ, выделяя их существенные признаки;
· характеризовать вещества по составу, строению и свойствам, устанавливать причинно-следственные связи между данными характеристиками вещества;
· изображать состав простейших веществ с помощью химических формул и сущность химических реакций с помощью химических уравнений;
· вычислять относительную молекулярную и молярную массы веществ, а также массовую долю химического элемента в соединениях для оценки их практической значимости;
· пользоваться лабораторным оборудованием и химической посудой;
· проводить несложные химические опыты и наблюдения за изменениями свойств веществ в процессе их превращений; соблюдать правила техники безопасности при проведении наблюдений и опытов;.
· различать виды химической связи: ионную, ковалентную полярную, ковалентную неполярную и металлическую;
· изображать электронно-ионные формулы веществ, образованных химическими связями разного вида;
· выявлять зависимость свойств веществ от строения их кристаллических решёток: ионных, атомных, молекулярных, металлических;
· характеризовать химические элементы и их соединения на основе положения элементов в периодической системе и особенностей строения их атомов;
· определять принадлежность неорганических веществ к одному из изученных классов/групп: металлы и неметаллы, оксиды, основания, кислоты, соли;
· составлять формулы веществ по их названиям;
· определять вещество-окислитель и вещество-восстановитель в окислительно-восстановительных реакциях;
· составлять окислительно-восстановительный баланс (для изученных реакций) по предложенным схемам реакций;
ОСНОВНАЯ ЧАСТЬ.
Изучение материалов ФГОС и разработка плана действии по реализации программ.
Раздел "Неметаллы " на уроках химии в 9 классе и занимает одно из главных мест, т.к. здесь идёт знакомство с важнейшими элементами, которые нас окружают. Знания, полученные на данном уроке, будут востребованы и при изучении курса химии в 9, 11 классах, при подготовке к ГИА и ЕГЭ.
Кроме того неметаллы
играют важную роль в жизни человека.
С неметаллами нам приходится сталкиваться ежедневно.
Особенности содержания обучения химии в средней школе обусловлены спецификой химии как науки и поставленными задачами. Основными проблемами химии являются изучение состава и строения веществ, зависимости их свойств от строения, получение веществ с заданными свойствами, исследование закономерностей химических реакций и путей управления ими в целях получения необходимых человеку веществ, материалов, энергии. Поэтому в рабочей программе по химии нашли отражение основные содержательные линии:
· «Вещество» — знания о составе и строении веществ, их важнейших физических и химических свойствах, биологическом действии;
· «Химическая реакция» — знания об условиях, в которых проявляются химические свойства веществ, способах управления химическими процессами;
· «Применение веществ» — знания и опыт практической деятельности с веществами, которые наиболее часто употребляются в повседневной жизни, широко используются в промышленности, сельском хозяйстве, на транспорте;
· «Язык химии» — система важнейших понятий химии и терминов, в которых они описываются, номенклатура неорганических и органических веществ, т. е. их названия (в том числе и тривиальные), химические формулы и уравнения, а также правила перевода информации с родного или русского языка на язык химии и обратно.
В 8 классе происходит знакомство с физическими и химическими явлениями, методом научного познания, формирование основных химических понятий, приобретение умений проводить практические работы по заданной схеме. В 9 классе начинается изучение основных семейств химических элементов, практические работы становятся более сложными, школьники учатся планировать эксперимент самостоятельно.
Все многообразие окружающей нас природы состоит из сочетаний сравнительно небольшого числа химических элементов.В различные исторические эпохи в понятие «элемент» вкладывался различный смысл. Древнегреческие философы в качестве «элементов» рассматривали четыре «стихии» – тепло, холод, сухость и влажность. Сочетаясь попарно, они образовывали четыре «начала» всех вещей – огонь, воздух, воду и землю. В средние века к этим началам добавились соль, сера и ртуть. В XVII веке Р. Бойль указал на то, что все элементы носят материальный характер и их число может быть достаточно велико. В 1787 году французский химик А. Лавуазье создал «Таблицу простых тел». В нее вошли все известные к тому времени элементы. Под последними понимались простые тела, которые не удавалось разложить химическими методами на еще более простые. Впоследствии выяснилось, что в таблицу вошли и некоторые сложные вещества.
В настоящее время понятие «химический элемент» установлено точно. Химический элемент – вид атомов с одинаковым положительным зарядом ядра. (Последний равен порядковому номеру элемента в таблице Менделеева.) В настоящее время известно 110 элементов. Около 90 из них существуют в природе. Остальные получены искусственно с помощью ядерных реакций. 104-107 элементы были синтезированы учеными-физиками в Объединенном институте ядерных исследований в городе Дубне. В настоящее время продолжаются работы по искусственному получению химических элементов с более высокими порядковыми элементами.
Все элементы делятся на металлы и неметаллы. Из 110 элементов 85 относятся к металлам. К неметаллам относят следующие элементы: гелий, неон, аргон, криптон, ксенон, радон, фтор, хлор, бром, йод, астат, кислород, сера, селен, теллур, азот, фосфор, мышьяк, углерод, кремний, бор, водород. Однако это деление условное. При определенных условиях некоторые металлы могут проявлять неметаллические свойства, а некоторые неметаллы металлические свойства.
Тематическое планирование по теме «Неметаллы»
|
№ п/п |
Тема и тип урока |
Дата |
Элементы содержания |
Планируемые результаты |
||
|
Предметные |
Метапредметные |
Личностные |
||||
|
29. |
Общая характеристика неметаллов
|
|
Общая характеристика неметаллов: положение в Периодической системе химических элементов Д. И. Менделеева, особенности строения атомов, электроотрицательность (ЭО) как мера «неметалличности», ряд ЭО. Кристаллическое строение неметаллов — простых веществ. Аллотропия. Физические свойства неметаллов. Относительность понятий «металл» и «неметалл»
|
Научатся: давать определения понятиям «электроотрицательность» « аллотропия» характеризовать неметаллы по их положению в ПСХЭ Д.И.Менделеева, описывать строение физические свойства неметаллов, объяснять зависимость свойств неметаллов от их положения ПСХЭ Д.И.Менделеева;составлять названия соединений неметаллов по формуле и формул по названию, научатся давать определения «аллотропия», «аллотропные модификации». Получат возможность научиться: прогнозировать свойства неизученных элементов и их соединений на основе знаний о периодическом законе |
Регулятивные: Планируют свои действия в связи с поставленной задачей и условиями ее решения Познавательные: Ставят и формулируют цели и проблемы урока Коммукативные: Адекватно используют речевые средства для эффективного решения коммуникативных задач |
Формирование готовности и способности к обучению и саморазвитию и самообразованию на основе мотивации к обучению и познанию |
|
30. |
Общие химические свойства неметаллов. Неметаллы в природе и способы их получения
|
|
Общие химические свойства неметаллов
|
Научатся: характеризовать строение неметаллов, общие химические свойства неметаллов, описывать общие химические свойства неметаллов с помощью языка химии, составлять уравнения химических реакций, характеризующих химические свойства неметаллов их соединений Получат возможность научиться: прогнозировать свойства неизученных элементов и их соединений на основе знаний о периодическом законе |
Регулятивные: Постановка учебной задачи на основе соотнесения того, что известно и усвоено , и того, что еще неизвестно Познавательные: Выдвижение гипотез, их обоснование, доказательство
Коммукативные: Учавствуют в коллективном обсуждении проблем, проявляют активность во взаимодействии для решения коммуникативных и познавательных задач |
Развивают осознанное отношение к своим собственным поступкам |
|
31. |
Водород
|
|
Положение водорода в Периодичеcкой системе химических элементов Д. И. Менделеева. Строение атома и молекулы. Физические и химические свойства водорода, его получение и применение. Лаб. опыты: 20. Получение и распознавание водорода
|
Научатся: характеризовать водород по его положению в ПСХЭ Д..И.Менделеева, характеризовать строение атома водорода, объяснять его возможные степени окисления, характеризовать физические и химические свойства водорода, объяснять зависимость свойств водорода от положения его в ПСХЭ Д.И.Менделеева, описывать лабораторные и промышленные способы получения водорода . Получат возможность научиться: объяснять двойственное положение водорода в ПСХЭ Д.И.Менделеева, грамотно обращаться с веществами в повседневной жизни |
Регулятивные: Различают способ и результат действия Познавательные: Владеют общим приемом решения задач Коммукативные: Договариваются о совместной деятельности под руководством учителя |
Формируют коммуникативный компонент в общении и сотрудничестве со сверстниками в процессе образовательной деятельности |
|
32. |
Вода
|
|
Строение молекулы. Водородная химическая связь. Физические свойства воды. Аномалии свойств воды. Гидрофильные и гидрофобные вещества. Химические свойства воды. Круговорот воды в природе. Водоочистка. Аэрация воды. Бытовые фильтры. Минеральные воды. Дистиллированная вода, ее получение и применение. Лаб. опыты: 21. Исследование поверхностного натяжения воды. 22. Растворение перманганата калия или медного купороса в воде. 23. Гидратация обезвоженного сульфата меди (II). 24. Изготовление гипсового отпечатка. 25. Ознакомление с коллекцией бытовых фильтров. 26. Ознакомление с составом минеральной воды |
Научатся : характеризовать строение молекулы водорода, физические и химические свойства воды, объяснять аномалии воды, способы очистки воды, применять в быту фильтры для очистки воды, правильно использовать минеральную воду, выполнять расчеты по уравнениям химических реакций, протекающих с участием воды. Получат возможность научиться: объективно оценивать информацию о веществах и химических процессах, критически относиться к псевдонаучной информации, недобросовестной рекламе |
Регулятивные: Планируют свои действия в связи с поставленной задачей и условиями ее решения Познавательные: Ставят и формулируют цели и проблемы урока Коммукативные: Контролируют действия партнера |
Имеют целостное мировоззрение, соответствующее современному уровню развития науки |
|
33. |
Галогены: общая характеристика |
|
Общая характеристика галогенов: строение атомов; простые вещества и основные соединения галогенов, их свойства. Краткие сведения о хлоре, броме, фторе и йоде. Применение галогенов и их соединений в народном хозяйстве. Демонстрации: Образцы галогенов — простых веществ. Взаимодействие галогенов с натрием, алюминием. Вытеснение хлором брома или йода из растворов их солей
|
Научатся: характеризовать строение молекул галогенов, описывать физические и химические свойства галогенов на основе наблюдений за их превращениями во время демонстрационных опытов, объяснять зависимость свойств галогенов их от положения в ПСХЭ Д.И. Менделеева, составлять формулы соединений галогенов и по формулам давать названия соединениям галогенов Получат возможность научиться: осознавать необходимость соблюдения правил экологической безопасности при обращении с галогенами |
Регулятивные: Планируют свои действия в связи с поставленной задачей и условиями ее решения Познавательные: Ставят и формулируют цели и проблемы урока Коммукативные: Адекватно используют речевые средства для эффективного решения коммуникативных задач |
Проявляют экологическое сознание |
|
34. |
Соединения галогенов |
|
Основные соединения галогенов: галогеноводороды, соли галогеноводородных кислот. Демонстрации: Образцы природных соединений хлора. Лаб. опыты: 27. Качественная реакция на галогенид-ионы
|
Научатся: устанавливать связь между свойствами соединений и их применением, изучать свойства соединений галогенов в ходе выполнения лабораторных опытов , Получат возможность научиться: использовать приобретенные компетенции при выполнении проектных работ по изучению свойств и способов получения и распознавания соединений галогенов |
Регулятивные: Учитывают правило в планировании и контроле способа решения Познавательные: Используют поиск необходимой информации для выполнения учебных заданий с использованием учебной литратуры Коммукативные: Учитывают разные мнения и стремятся к координации различных позиций в сотрудничестве |
Воспитание ответственного отношения к природе |
|
35. |
Практическая работа №4 Решение экспериментальных задач по теме «Подгруппа галогенов» |
|
Решение экспериментальных задач по теме «Подгруппа галогенов»
|
Научатся: обращаться с лабораторным оборудованием и нагревательными приборами в соответствии с правилами техники безопасности, описывать химический эксперимент с помощью языка химии, делать выводы по результатам эксперимента. Получат возможность научиться: осознавать необходимость соблюдения правилТБ и ОТ для сохранения своего здоровья и окружающих |
Регулятивные: Осуществляют пошаговый контроль по результату
Познавательные: Проводят сравнение и классификацию по заданным критериям Коммукативные: Находят общее решение учебной задачи |
Овладение навыками для практической деятельности |
|
36. |
Кислород
|
|
Строение атома и аллотропия кислорода; свойства и применение его аллотропных модификаций. Лаб. опыты: 28. Получение и распознавание кислорода
|
Научатся:, характеризовать строение молекулы кислорода, составлять химические уравнения, характеризующие химические свойства кислорода, объяснять применение аллотропных модификаций кислорода, описывать лабораторные и промышленные способы получения кислорода . Получат возможность научиться: грамотно обращаться с веществами в повседневной жизни |
Регулятивные: Различают способ и результат действия Познавательные: Владеют общим приемом решения задач Коммукативные: Договариваются о совместной деятельности под руководством учителя |
Стремление к здоровому образу жизни |
|
37. |
Сера, ее физичекие и химические свойства
|
|
Строение атома и аллотропия серы; свойства и применение ромбической серы. Демонстрации: Взаимодействие серы с металлами, водородом и кислородом. Лаб. опыты: 29. Горение серы на воздухе и в кислороде
|
Научатся:, характеризовать строение молекулы серы объяснять зависимость свойств серы от ее положения в ПСХЭ Д.И. Менделеева, составлять химические уравнения, характеризующие химические свойства серы, объяснять применение аллотропных модификаций серы Получат возможность научиться: грамотно обращаться с веществами в повседневной жизни |
Регулятивные: Различают способ и результат действия Познавательные: Владеют общим приемом решения задач Коммукативные: Договариваются о совместной деятельности, приходя к общему решению |
Формируют основы экологического мышления |
|
38. |
Соединения серы
|
|
Оксиды серы (IV) и (VI); их получение, свойства и применение |
Научатся:, описывать свойства соединений серы, составлять уравнения реакций, соответствующих «цепочке» превращений Получат возможность научиться: прогнозировать химические свойства веществ на основе их свойств и строения
|
Регулятивные: Учитывают правило в планировании и контроле способа решения Познавательные: Используют поиск необходимой информации для выполнения учебных заданий с использованием учебной литратуры Коммукативные: Контролируют действие партнера |
Формируют интерес к конкретному химическому элементу, поиск дополнительной информации о нем. |
|
39. |
Серная кислота как электролит и ее соли |
|
Серная кислота как электролит и ее соли, их применение в народном хозяйстве. Демонстрации: Образцы природных соединений серы. Образцы важнейших для народного хозяйства сульфатов. Лаб. опыты: 30. Свойства разбавленной серной кислоты
|
Научатся:, описывать свойства серной кислоты, в ходе проведения лабораторных опытов , проводить качественную реакцию на сульфат - ион Получат возможность научиться: характеризовать особые свойства концентрированной серной кислоты |
Регулятивные: Различают способ и результат действия Познавательные: Владеют общим приемом решения задач Коммукативные: Договариваются о совместной деятельностм, приходят к общему решению |
|
|
40. |
Серная кислота как окислитель. Получение и применение серной кислоты
|
|
Серная кислота как окислитель. Производство серной кислоты и ее применение
|
Научатся :составлять уравнения ОВР с участием серной кислоты, описывать области применения серной кислоты Получат возможность научиться: приводить примеры уравнений реакций, лежащих в основе производства серной кислоты |
Регулятивные: Планируют свои действия в соответствии с поставленной задачей и условиями ее реализации Познавательные: Владеют общим приемом решения задач Коммукативные: Контолируют действия партнера |
Испытывают чувство гордости за российскую науку |
|
41. |
Практическая работа №5 Решение экспериментальных задач по теме «Подгруппа кислорода» |
|
Решение экспериментальных задач по теме «Подгруппа кислорода»
|
Научатся: обращаться с лабораторным оборудованием и нагревательными приборами в соответствии с правилами техники безопасности, описывать химический эксперимент с помощью языка химии, делать выводы по результатам эксперимента. Получат возможность научиться: осознавать необходимость соблюдения правилТБ и ОТ для сохранения своего здоровья и окружающих |
Регулятивные: Осуществляют пошаговый контроль по результату
Познавательные: Строят речевое высказывание в устной и письменной форме
Коммукативные: Учитывают разные мнения и стремятся к координации различных позиций в сотрудничестве |
Умеют управлять своей познавательной деятельностью |
|
42. |
Азот и его свойства
|
|
Строение атома и молекулы азота; свойства азота как простого вещества
|
Научатся:, характеризовать строение атома и молекулы азота, объяснять зависимость свойств азота от его положения в ПСХЭ Д.И. Менделеева, составлять химические уравнения, характеризующие химические свойства азота Получат возможность научиться: грамотно обращаться с веществами в повседневной жизни |
Регулятивные: Планируют свои действия в связи с поставленной задачей и условиями ее решения Познавательные: Ставят и формулируют цели и проблемы урока Коммукативные: Адекватно используют речевые средства для эффективного решения коммуникативных задач |
Формируют интерес к конкретному химическому элементу |
|
43. |
Аммиак и его соединения. Соли аммония |
|
Аммиак, строение, свойства, получение и применение. Соли аммония, их свойства и применение. Лаб. опыты: 31. Изучение свойств аммиака. 32. Распознавание солей аммония
|
Научатся: описывать свойства аммиака в ходе проведения лабораторных опытов, проводить качественную реакцию на ион -аммония Получат возможность научиться: приводить примеры уравнений реакций, лежащих в основе промышленных способов получения аммиака |
Регулятивные: Планируют свои действия в связи с поставленной задачей и условиями ее решения Познавательные: Ставят и формулируют цели и проблемы урока Коммукативные: Контролируют действия партнера |
|
|
44. |
Оксиды азота |
|
Оксиды азота(II) и (IV) |
Научатся:, описывать свойства соединений азота, составлять уравнения реакций, соответствующих «цепочке» превращений Получат возможность научиться: прогнозировать химические свойства веществ на основе их свойств и строения |
Регулятивные: Учитывают правило в планировании и контроле способа решения Познавательные: Используют поиск необходимой информации для выполнения учебных заданий с использованием учебной литратуры Коммукативные: Контролируют действие партнера |
|
|
45. |
Азотная кислота как электролит, её применение |
|
Азотная кислота как электролит, ее свойства и применение. Демонстрации: Образцы важнейших для народного хозяйства нитратов. Лаб. опыты: 33. Свойства разбавленной азотной кислоты
|
Научатся:, описывать свойства азотной кислоты, в ходе проведения лабораторных опытов Получат возможность научиться: составлять «цепочки» превращений по азоту |
Регулятивные: Различают способ и результат действия Познавательные: Владеют общим приемом решения задач Коммукативные: Договариваются о совместной деятельностм, приходят к общему решению |
|
|
46. |
Азотная кислота как окислитель, её получение |
|
Азотная кислота как окислитель. Нитраты и нитриты, проблема их содержания в с/х продукции. Азотные удобрения Демонстрации: Взаимодействие концентрированной азотной кислоты с медью. Лаб. опыты: 34. Взаимодействие концентрированной азотной кислоты с медью
|
Научатся :составлять уравнения ОВР с участием азотной кислоты, применять соли азотной кислоты в практической деятельности, проводить качественную реакцию на нитрат - ион Получат возможность научиться: характеризовать особые свойства концентрированной азотной кислоты |
Регулятивные: Планируют свои действия в соответствии с поставленной задачей и условиями ее реализации Познавательные: Владеют общим приемом решения задач Коммукативные: Контолируют действия партнера |
|
|
47. |
Фосфор. Соединения фосфора. Понятие о фосфорных удобрениях |
|
Строение атома и аллотропия фосфора, свойства белого и красного фосфора, их применение. Основные соединения: оксид фосфора (V) и ортофосфорная кис- лота, фосфаты. Фосфорные удобрения. Демонстрации: Образцы природных соединений фосфора. Образцы важнейших для народного хозяйства фосфатов. Лаб. опыты: 35. Горение фосфора на воздухе и в кислороде. 36. Распознавание фосфатов
|
Научатся: характеризовать строение атома фосфора, объяснять зависимость свойств фосфора от его положения в ПСХЭ Д.И. Менделеева, составлять химические уравнения, характеризующие химические свойства азота в результате проведения лабораторных опытов, проводить качественную реакцию на фосфат - ион Получат возможность научиться: описывать физические и химические процессы, являющиеся частью круговорота веществ в природе |
Регулятивные: Планируют свои действия в связи с поставленной задачей и условиями ее решения Познавательные: Ставят и формулируют цели и проблемы урока Коммукативные: Адекватно используют речевые средства для эффективного решения коммуникативных задач |
Формируют интерес к конкретному химическому элементу, поиск дополнительной информации о нем. |
|
48. |
Углерод
|
|
Строение атома и аллотропия углерода, свойства его модификаций и их применение. Демонстрации: Поглощение углем растворенных веществ или газов. Восстановление меди из ее оксида углем. Лаб. опыты: 37. Горение угля в кислороде
|
Научатся: характеризовать строение атома углерода, объяснять зависимость свойств углерода от его положения в ПСХЭ Д.И. Менделеева, составлять химические уравнения, характеризующие химические свойства углерода Получат возможность научиться: описывать физические и химические процессы, являющиеся частью круговорота веществ в природе |
Регулятивные: Различают способ и результат действия Познавательные: Владеют общим приемом решения задач Коммукативные: Договариваются о совместной деятельности под руководством учителя |
Формируют интересс к конкретному химическому элементу, поиск дополнительной информации о нем. |
|
49. |
Оксиды углерода
|
|
Оксиды углерода (II) и (IV), их свойства и применение |
Научатся:, описывать свойства оксидов углерода, составлять уравнения реакций, соответствующих «цепочке» превращений . проводить качественную реакцию по распознаванию углекислого газа Получат возможность научиться: прогнозировать химические свойства веществ на основе их свойств и строения |
Регулятивные: Учитывают правило в планировании и контроле способа решения Познавательные: Используют поиск необходимой информации для выполнения учебных заданий с использованием учебной литратуры Коммукативные: Контролируют действие партнера |
Формируют умение использовать знания в быту |
|
50. |
Угольная кислота и её соли. Жесткость воды и способы её устранения
|
|
Угольная кислота. Соли угольной кислоты: кальцит, сода, поташ, их значение и природе и жизни человека. Жесткость воды и способы ее устранения. Демонстрации: Образцы природных соединений углерода. Образцы важнейших для народного хозяйства карбонатов. Лаб. опыты: 38. Получение угольной кислоты и изучение ее свойств. 39. Переход карбонатов в гидрокарбонаты. 40. Разложение гидрокарбоната натрия |
Научатся: давать определения понятиям «жесткость воды» ,описывать свойства угольной кислоты, составлять уравнения реакций, соответствующих «цепочке» превращений , составлять названия солей угольной кислоты, проводить качественную реакцию на карбонат - ион Получат возможность научиться: прогнозировать химические свойства веществ на основе их свойств и строения |
Регулятивные: Различают способ и результат действия Познавательные: Владеют общим приемом решения задач Коммукативные: Договариваются о совместной деятельностм, приходят к общему решению |
Формируют умения использовать знания в быту |
|
51. |
Кремний
|
|
Строение атома кремния; кристаллический кремний, его свойства и применение |
Научатся:, характеризовать строение атома кремния, объяснять зависимость свойств кремния от его положения в ПСХЭ Д.И. Менделеева, составлять химические уравнения, характеризующие химические свойства кремния Получат возможность научиться: грамотно обращаться с веществами в повседневной жизни |
Регулятивные: Адекватно воспринимают предложения и оценку учителя и одноклаасников Познавательные: Выбирают наиболее эффективные способы решения задач, контролируют и оценивают процесс и результат деятельности Коммукативные: Договариваются о распределении функций и ролей в совместной деятельности |
Формируют интереса к конкретному химическому элементу, поиск дополнительной информации о нем. |
|
52. |
Соединения кремния |
|
Оксид кремния (IV), его природные разновидности. Силикаты. Значение соединений кремния в живой и неживой природе. Демонстрации: Образцы природных соединений кремния. Лаб. опыты: 41. Получение кремневой кислоты и изучение ее свойств
|
Научатся:, описывать свойства оксида кремния, составлять уравнения реакций, соответствующих «цепочке» превращений . проводить качественную реакцию на силикат - ион Получат возможность научиться: прогнозировать химические свойства веществ на основе их свойств и строения
|
Регулятивные: Учитывают правило в планировании и контроле способа решения Познавательные: Используют поиск необходимой информации для выполнения учебных заданий с использованием учебной литратуры Коммукативные: Учитывают разные мнения и стремятся к координации различных позиций в сотрудничестве |
|
|
53. |
Силикатная промышленность |
|
Понятие о силикатной промышленности. Стекло, цемент, керамика. Демонстрации: Образцы стекла, керамики, цемента
|
Научатся: практическому применению соединений кремния Получат возможность научиться: прогнозировать химические свойства веществ на основе их свойств и строения
|
Регулятивные: Различают способ и результат действия Познавательные: Владеют общим приемом решения задач Коммукативные: Договариваются о совместной деятельности под руководством учителя |
Формируют понимание особенностей жизни и труда в условиях информатизации общества |
|
54. |
Практическая работа №6 Получение, собирание и распознавание газов |
|
Получение, собирание и распознавание газов
|
Научатся: обращаться с лабораторным оборудованием и нагревательными приборами в соответствии с правилами техники безопасности, описывать химический эксперимент с помощью языка химии, делать выводы по результатам эксперимента. Получат возможность научиться: осознавать необходимость соблюдения правилТБ и ОТ для сохранения своего здоровья и окружающих |
Регулятивные: Осуществляют пошаговый контроль по результату
Познавательные: Строят речевое высказывание в устной и письменной форме Коммукативные: Учитывают разные мнения и стремятся к координации различных позиций в сотрудничестве |
Овладение навыками для практической деятельности |
|
55. |
Обобщение по теме «Неметаллы» |
|
|
Научатся: обобщать знания и представлять их схем, таблиц, презентаций |
Регулятивные: Вносят необходимые коррективы в действие после его завершения на основе его учета сделанных ошибок Познавательные: Строят речевое высказывание в устной и письменной форме Коммукативные: Корректируют действия партнера |
Выражают адекватное понимание причин успеха и неуспеха учебной деятельности |
|
56. |
Контрольная работа №3 по теме «Неметаллы» |
|
Контроль предметных и метапредметных учебных действий по теме «Неметаллы» |
Научатся: применять полученные знания и сформированные умения для решения учебных задач |
Регулятивные: осуществляют пошаговый и итоговый контроль по результату Познавательные: строят речевое высказывание в устной и письменной форме Коммукативные: учитывают разные мнения и стремяться к координации различных позиций в |
Проявляют ответственность за результаты |
Тема урока: Неметаллы
Цели и задачи урока
Задачи урока:
- актуализировать и обобщить имеющиеся у учащихся знания по данной теме;
- вызвать устойчивый интерес к изучаемой теме, мотивировать учебную деятельность учащихся;
- побудить учащихся к активной работе на уроке и дома;
- создать условия для целостного осмысления и обобщения информации учащимися;
- сформировать у каждого учащегося собственное отношение к изучаемому материалу.
Цели урока:
Образовательные
- обеспечить усвоение учащимися знаний о положении неметаллов в Периодической системе Д.И.Менделеева, особенностях строения их атомов, физических и химических свойствах;
- актуализировать знания учащихся о явлении аллотропии для представления общей характеристики неметаллов;
Воспитательные
- вызвать интерес к предмету, воспитать чувство взаимовыручки, самостоятельность, дисциплинированность;
Развивающие
- создать условия для становления навыков самостоятельной и коллективной работы.
Здоровьесберегающие
- выстраивание модели здоровье сберегающего урока.
В процессе урока осуществляется формирование следующих общекультурных компетенций учащихся:
- владения культурой мышления, способности формулировать понятия и суждения, индуктивные и дедуктивные умозаключения;
- умения анализировать логику рассуждений и высказываний, способности выявлять значение, смысловое содержание в услышанном, увиденном или прочитанном;
- готовности к кооперации с коллегами, работе в коллективе, умения организовать работу коллектива исполнителей;
- способности и готовности к самосовершенствованию, саморегулированию, самореализации, личностной и предметной рефлексии;
Планируемые результаты
Предметные: понятие «электроотрицательность» « аллотропия» характеризовать неметаллы по их положению в ПСХЭ Д.И.Менделеева, описывать строение физические свойства неметаллов, объяснять зависимость свойств неметаллов от их положения ПСХЭ Д.И.Менделеева;
Метапредметные:
Регулятивные:
Планируют свои действия в связи с поставленной задачей и условиями ее решения
Познавательные:
Ставят и формулируют цели и проблемы урока
Коммуникативные: Адекватно используют речевые средства для эффективного решения коммуникативных задач.
Личностные: Формирование готовности и способности к обучению и саморазвитию и самообразованию на основе мотивации к обучению и познанию.
Ход урока
I. Организационный момент.
Учитель сообщает цели и задачи урока.
II. Стадия вызова.
С целью актуализации знаний учитель демонстрирует на слайде и зачитывает цитату из книги Ганты Тибор «Жизнь и ее происхождение».
«Прежде чем приступить к разговору об интересной истории образования Земли, нам необходимо ознакомиться с элементарным составом вселенной. Если бы нам удалось каким-то образом получить усредненный образец материала, из которого построена вселенная, подсчитать и сгруппировать все отдельные атомы, мы с удивлением обнаружили бы, что атомы самого легкого элемента являются самыми распространенными, а также в первенстве ему не уступают еще три химических элемента, которые являются важнейшими компонентами живой материи…»
Вопрос к классу: «О каких химических элементах идет речь?
Определите тему урока». С помощью учителя в результате дискуссии учащиеся определяют, о каких элементах идет речь (H; C; N; O) и формулируют тему урока.
Учитель: «Итак, тема сегодняшнего урока «Неметаллы». Мы постараемся провести их сравнительную характеристику на примере углерода, азота и кислорода».
«Какие характеристики свойственны неметаллам (физические и химические свойства, строение атома, кристаллическая решетка и т.д.)?».
Учащиеся, работая в парах, записывают характеристики на листочках и передают учителю, формируя таким образом «Корзину понятий и идей».
Учитель: «Давайте вспомним, где располагаются неметаллы в Периодической системе (Периодической Системы)?». Учащиеся, анализируя ПС, отмечают, что все они, кроме водорода, располагаются в верхней правой части ПС, в основном по диагонали бор-астат и над ней. Учитель сообщает, что в ПС 22 элемента являются неметаллами.
Учитель демонстрирует образцы неметаллов: серы, йода, графита, активированного угля, кристаллического кремния.
Для неметаллов более характерно различие в свойствах (физических, химических), чем общность. Для того, чтобы дать полную характеристику неметаллам, предлагается заполнить конструктивную таблицу, бланки которой раздает учитель (таблицы.). Работая в парах с этой таблицей, учащиеся могут дать полную характеристику предложенным неметаллам, используя также справочную литературу.
Каждая колонка учащихся класса работает над своим неметаллом (углерод, азот, кислород).
После окончания времени работы над конструктивной таблицей совместно с учителем проводится проверка правильности ее заполнения и учащиеся заполняют оставшиеся графы. При этом используются слайды, демонстрируемые с помощью проектора, на которых последовательно представляется процесс заполнения таблицы правильными ответами.
Таблица
Сравнительная характеристика неметаллов
на примере углерода, азота и кислорода
|
|
Параметры сравнения |
Углерод |
Азот |
Кислород |
|
|
Строение атомов неметаллов |
|
|
|
|
1 |
Электронная схема и графическая формула, количество электронов на внешнем энергетическом уровне |
|
|
|
|
2 |
Возможные степени окисления |
|
|
|
|
3 |
Размер радиуса атома |
|
|
|
|
|
Формулы простых веществ. Аллотропия |
|
|
|
|
|
Строение простого вещества |
|
|
|
|
1 |
Химическая связь |
|
|
|
|
2 |
Кристаллическая решетка |
|
|
|
|
|
Физические свойства |
|
|
|
|
1 |
Агрегатное состояние |
|
|
|
|
2 |
Окраска неметаллов |
|
|
|
|
3 |
Температура плавления |
|
|
|
|
|
Химические свойства |
|
|
|
В заключение стадии вызова подробно рассматривается понятие аллотропии и выясняется причина аллотропии неметаллов.
Учитель: «Угадайте, о каком химическом элементе идет речь?
…Без него мрамор превратился в негашёную известь, а природные газ и нефть в водородное облако.
…Его скрывают под именами карбин, графит, сажа, алмаз, фуллерен.
Учащиеся отвечают на вопросы.
1) Приведите примеры аллотропии.
2) Что такое аллотропные модификации?
3) Чем отличаются аллотропные модификации?
В процессе беседы акцентируется внимание учащихся на различие физических и химических свойств аллотропных модификаций, демонстрируются слайды аллотропных модификаций углерода (алмаз, графит, карбин, фуллерен) и кислорода (кислород, озон).
III. Стадия осмысления.
Учитель: «… Итак, состав определяет строение, а строение − свойства. Это неразрывно связанные понятия, которые невозможно рассматривать одно без другого».
На этом этапе учащиеся получают задание (на слайде) и, работая в паре и задавая вопросы друг другу, выясняют, в каких случаях неметаллы проявляют окислительные и восстановительные свойства. Каждая колонка выполняет одно из следующих заданий:
а) S0→ S+4 б) N0→ N-3 в) C0→ C+4
S0→ S-2 N0→ N+2 C0→ C-4
Необходимо подтвердить окислительно-восстановительные возможности простых веществ неметаллов. На оценку «3» достаточно написать химическое уравнение, на «4» - химическое уравнение с электронным балансом, на «5» - кроме того, ответить на вопрос: «Что общего и в чем различие разных неметаллов? У каких из них различия проявляются в большей степени и почему?»
IV. Стадия рефлексии.
Учащимся предлагается, работая в группах, составить фломастерами на листах бумаги формата А3 графический организатор-кластер по данной теме.
Составленные кластеры вывешиваются на доске, проводится их анализ.
Подводится итог урока, учащиеся с помощью учителя формулируют основные выводы.
Далее выполняется рефлексивный тест. Предъявляются следующие утверждения.
1) Я вспомнил много из того, что мы изучали раньше.
2) Думаю, что эти знания еще понадобятся мне на уроках химии
3) Пришлось подумать, отвечая на задаваемые на уроке вопросы.
4) Неясных вопросов после проведения урока не осталось.
5) На уроке я работал в полную силу и удовлетворен достигнутым результатом.
Каждое утверждение, с которым учащийся согласен, помечается им «плюсом».
Учитель: «По окончании теста прошу поднять руки тех, кто поставил 5 плюсов, затем 4 и 3 плюса. Это именно те оценки, которые вы поставили себе за урок.
Литература
1.Ганты Тибор.Жизнь и ее происхождение. М.: Просвещение, 1984.
2. Петров А.А. Справочник по химии для школьников. М.: Лист, 1998
Конспект открытого урока
Урок-конференция по химии для учащихся 9 класса на тему
"Великий Кислород"
1.Кислород, его общая характеристика и нахождение в природе.
2.Получение кислорода. Свойства кислорода.
3.Применение кислорода.
4.Круговорот кислорода в природе.
Цели урока:
1. Организовать деятельность учащихся по обобщению знаний о кислороде как самом распространенном химическом элементе на земле, расширить их представления о свойствах кислорода, его значении для живых существ, показать необходимость предотвращения загрязнения атмосферы.
2. Установление межпредметных связей между химией и биологией, физикой, историей, экологией, литературой.
3. Продолжать развивать умения учащихся самостоятельно работать с дополнительной литературой.
4. Обеспечить условия для экологического просвещения учащихся.
Оформление: запись темы на доске, портреты Д.Пристли, К. Шееле, М.Ломоносова и А.Лавуазье.
Оборудование и реактивы: Компьютер, видеофрагменты из единой коллекции цифровых образовательных ресурсов; портреты ученых; стенд со списком используемой учащимися литературы; выставка дополнительной литературы; пробирки, нагревательный прибор, штатив, лучинки, колбы, H2O2.
Тип урока: Урок-конференция (с использованием художественной литературы). Методы и формы обучения: частично-поисковый, групповой, объяснительно-иллюстративный, эвристическая беседа.
Планируемые результаты: Предметные: научатся характеризовать строение молекулы кислорода, составлять химические уравнения, характеризующие химические свойства кислорода, объяснять применение аллотропных модификаций кислорода.Регулятивные:Различают способ и результат действия Познавательные:Владеют общим приемом решения задач.
Личностные:стремление к здоровому образу жизни.
Коммукативные:Договариваются о совместной деятельности под руководством учителя
Подготовка к конференции: на конференции выступают: историки, химики-теоретики, химики- практики, биологи, экологи, литераторы и поэты. Учащиеся заранее готовятся по следующим вопросам темы:
1. История открытия кислорода.
2. Нахождение кислорода в природе.
3. Получение кислорода в лаборатории и промышленности.
4. Использование кислорода.
5. Писатели и поэты о кислороде.
Ход урока
1. Организационный этап. Здравствуйте ребята, садитесь. Прежде чем мы начнем заниматься делом, я хотел бы, чтобы каждый из вас настроился на урок. Перед вами лежат карточки разных цветов. Если в конце урока вы почувствуете, что ваши знания и настроение улучшились – поднимите карточку красного цвета, если вы получили недостаточно информации – синего, а если урок не принес вам полезных знаний и удовлетворения – зеленого цвета.
2. Этап актуализации знаний. Учитель. По мнению людей религиозных, вездесущим, всемогущим и в то же время невидимым может быть только бог. В действительности эти три эпитета вполне можно отнести и к химическому элементу, о котором пойдет речь на нашем уроке
В чем горят дрова и газ,
Фосфор, водород, алмаз?
Дышит чем любой из нас
Каждый миг, и каждый час?
Без чего мертва природа?
Правильно, без ………. Учащиеся: Кислорода!
Учитель. Тема нашего урока - «Кислород». На нем мы постараемся обобщить и закрепить знания по теме, расширить ваше представление о кислороде, его значении для живых существ; о связи других предметов с химией. Сегодня перед нами стоит задача: докажите, что кислород вездесущ, всемогущ и невидим. Дома вы все изучили историю открытия элемента, придумывали или находили стихи о кислороде, исследовали материал по биологии, экологии, работая в группах.
3 этап. Анализ изученного, выделение главного, систематизация и обобщение знаний. Первыми выступят историки, которые расскажут об истории открытия этого удивительного элемента.
Историк 1. Многие ученые прошлого догадывались, что существует вещество со свойствами, присущими кислороду. Сведения о нем – косвенные, разумеется,- есть в трактате китайского алхимика Мао Хао (VIII в.). Китайцы знали «деятельное начало», входящее в состав воздуха, и называли его «йын». В XV в. следы кислорода можно обнаружить в трудах Леонардо да Винчи. Потом снова теряются - до XVII в., когда голландец Дреббель изобретает подводную лодку.
Он использует селитру, чтобы ее кислородом обогатить воздух в подводной лодке. Но этот факт остался незамеченным. В 1758 году М.В.Ломоносов на основании своих опытов доказал, что в состав воздуха входит вещество, окисляющее металл. Открытие кислорода является одним из важнейших событий в истории элементов, но и химии вообще и связано с именами Д. Пристли, К. Шееле и А. Лавуазье.
Поэт:
Когда-то в Древней Англии
Великий Пристли жил.
Все соблюдая правила
Оксид он разложил.
Под куполом сосуда
Бесцветный газ собрал.
Старательно исследуя, его он описал.
Не видим и безвкусен,
Всех запахов лишен,
В воде не растворяется,
Свеча сгорает в нем.
Ученый в изумлении:
Ну что за чудеса?
Горят легко в нем многие
Простые вещества.
Этот газ из колбы вышел,
Никому он не знаком
Этим газом дышат мыши,
Под стеклянным колпаком!
Дрова лучистым пламенем
Сгорали в нем, понятно,
Сам пробовал дышать –
Легко дышать, приятно!
Историк 2. Вот как об этом писал сам Джозеф Пристли: «1 августа 1774 г. Я попытался извлечь воздух из ртутной окалины (оксида ртути) и нашел, что воздух легко может быть изгнан из нее посредством линзы. Этот воздух не поглощался водой. Каково же было мое изумление, когда я обнаружил, что свеча горит в этом воздухе необычайно ярким пламенем. Тщетно пытался я найти объяснение этому явлению».
Историк 3. Полгода спустя Д. Пристли осуществил опыт с мышами, поместив одну в сосуд с кислородом, а другую в такой же сосуд с воздухом, и обнаружил, что в кислороде живые существа живут дольше, чем в воздухе. Затем он сам пробовал дышать полученным газом и убедился, что дышится чрезвычайно им «свободно и легко».


Рис.1 «Опыт Дж. Пристли с мышами» Рис.2 Портрет Джозефа Пристли.
Историк 4. Одновременно с Пристли кислород открыл и шведский ученый Карл Шееле. Шееле даже получил его раньше, чем Пристли, но сообщение об этом было опубликовано позже, чем открытие Пристли.И все-таки главная фигура в истории открытия кислорода – не Шееле и не Пристли. Они открыли новый газ – и только. Собственно открывшим кислород остается французский химик Антуан Лавуазье.
В 1775 году он исследовал кислород и создал кислородную теорию горения, которая пришла на смену теории флогистона (теория огненной материи). За два века, прошедшие со времени открытия, теория Лавуазье не только не была опровергнута, но еще более укрепилась. Лавуазье дал название кислороду oxygenium – рождающий кислоту.


Рис.3. Портрет К. Шееле. Рис.4 Портрет А. Лавуазье
Учитель. Вездесущность кислорода нам докажут ученые химики-теоретикиХимик-теоретик 1. В атмосфере нашей планеты находится приблизительно 21% свободного кислорода (по объему). Количество его в земной коре в виде химических соединений с другими элементами составляет49%. Кислород - химически активный элемент. В состав половины из 4 тысяч известных в настоящее время неорганических веществ, входит кислород. В связанном виде он находится в почве, минералах и рудах. В составе воды рек, озер, морей, океанов содержится до 89% кислорода, в песке его доля достигает 53%, в глине- 56%.
Организм человека содержит до 65% кислорода в связанном состоянии. Кислород является важным составляющим элементом растений и животных.
Учитель. Итак, мы
доказали, что кислород вездесущ. А теперь мы узнаем, в самом ли деле он
невидим. Докажет нам это группа №3..
Химик-теоретик 2:. Кислород при нормальных условиях бесцветный газ без запаха и вкуса, но если его сжижать, то можно увидеть воочию. Вот как описаны свойства жидкого воздуха в повести писателя – фантаста А.Беляева «Продавец воздуха». «Мистер Бейли открыл шестую дверь, и я увидел изумительное зрелище. Перед нами был огромный подземный грот. Десятки ламп освещали большое озеро, вода которого отличалась необычайно красивым голубым цветом. Казалось, как будто в эту подземную пещеру упал кусок голубого неба. «- Жидкий воздух, - сказал Бейли».
Сжижается газ, если его охладить до температуры -183С0 при н.у. Если снизить температуру до -218,8С0, то жидкий кислород превратится в красивые синие кристаллы.
Учитель. Еще Лавуазье отмечал, что кислород поддерживает горение и дыхание. Значит, мы с вами, используя кислород воздуха, уменьшаем его количество. Как же поддерживается необходимое нам постоянное содержание кислорода в воздухе?
Химик-теоретик 3. Исключительно важна роль кислорода в процессе дыхания человека и животных. Растения также поглощают атмосферный кислород. Но если в темноте идет только процесс поглощения растениями кислорода, то на свету протекает еще один противоположный ему процесс- фотосинтез, в результате которого растения поглощают углекислый газ и выделяют кислород. Так как процесс фотосинтеза идет более интенсивно, то в итоге на свету растения выделяют гораздо больше кислорода, чем поглощают его при дыхании. Таким образом, содержание свободного кислорода Земли сохраняется благодаря жизнедеятельности зеленых растений.
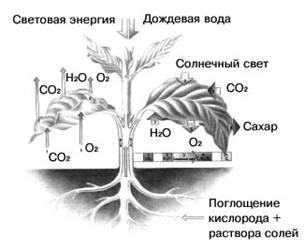
Рис.6 « Схема фотосинтеза растениями»
Биолог 1. Благодаря солнечному свету и хлорофиллу углекислый газ поглощается растениями, выделяющими кислород, так необходимый человеку и животным. Самыми активными «производителями» кислорода являются не растения, которые мы видим на суше, а бесчисленные мелкие водоросли, произрастающие в поверхностных теплых слоях морей и океанов. Подсчитано, что сухопутные растения вырабатывают ежегодно 53 млрд. тонн кислорода, а водоросли – почти в 10 раз больше. Было определено также, что населению Земли и животным нужно две тысячи лет, чтобы исчерпать весь кислород атмосферы, а растениям и водорослям достаточно 600 лет, чтобы восстановить массу кислорода в воздухе, окружающем Землю.
Химик – практик 1. Чтобы получить чистый кислород, нужны исходные вещества, богатые этим элементом. В лаборатории его получают разложением перманганата калия или каталитическим разложением пероксида водорода. Проведем химический эксперимент
Опыт 1. Получение кислорода разложением перманганата калия.
![]() Запись уравнения реакции: 2KMnO4 K2MnO4
+ 3O2
Запись уравнения реакции: 2KMnO4 K2MnO4
+ 3O2
Опыт 2. Получение кислорода каталитическим разложением пероксида водорода. (Химический эксперимент)
![]() Запись уравнений реакций:
2Н2О2 О2 + 2 Н2О
Запись уравнений реакций:
2Н2О2 О2 + 2 Н2О
Учитель 4. А вот как предлагал получить кислород в лаборатории Жюль Верн в романе «Опыт доктора Окса». «Доктор, искусный химик, умел получать этот газ в больших количествах и дешево, не пользуясь марганцевокислым натрием, по методу Гессье дю- Мотэ, а просто разлагал слегка подкисленную воду с помощью изобретенной им батареи. Электрический ток проходил сквозь большие чаны, наполненные водой, и жидкая стихия разлагалась на составные части - кислород и водород». (Запись уравнения реакции).
Учитель. А как же получают кислород в промышленности? . В настоящее время промышленным способом получения кислорода является извлечение его из воздуха сжижением с последующей ректификацией. Кислород образует так много соединений потому, что он химически активный. Каковы же химические свойства кислорода?
Учащийся: Для кислорода характерны реакции горения, при которых происходит окисление веществ с выделением теплоты и света.
Опыт 1 Горение углерода. (Демонстрируется видеофрагмент.).
Уголек в кислороде не гаснет
Раскаляется он добела.
Дым, и пламя не выделяя,
Углекислый газ сотворя.
Опыт 2. Горение серы. (Демонстрируется видеофрагмент).
Подмигнув лиловым глазом,
Сера быстро стала газом.
Ох, не радует он нас
Ядовит сернистый газ.
Опыт 3. Горение железа. (Демонстрируется видеофрагмент).
Взяли в ложечке железо
Заискрилось и оно.
Магний, цинк или рубидий,
Всем сгорать им суждено.
Кислород энергично окисляет не только простые, но и сложные вещества, при этом, образуя оксиды элементов, из которых они состоят.
(Запись уравнений реакций)
Учитель: Исключительно важна роль кислорода в процессе дыхания человека и животных. Давайте вспомним. У самого берега возле стебля тростника повис вниз головой жук-плавунец. Что он высматривает на дне? Возле него расположились какие-то личинки, также вниз головой, выставив над водой свои «хвостики». Слово предоставляется группе биологов.
Биолог 1. Жук и личинка запасаются кислородом. Поднимаясь на поверхность воды, жук выставляет из воды задний конец своего тела, и некоторое время остается висеть в этой позе совершенно неподвижно. Воздух поступает через дыхальца, открывающиеся на спинной стороне его брюшных колец. Дыхальца – отверстия в брюшке (у личинок они находятся в «хвостиках»), от них отходят трахеи трубочки к каждому органу жука. Кислород воздуха из трахеи проникает в каждую клетку организма жука, а углекислый газ из клеток проникает в трахеи и выводится наружу.
Учитель. Совсем близко к берегу подплыла рыбка. Вы видите ее темную спинку и замечаете, как периодически движутся у нее жаберные крышки. Почему?
Биолог 1. Она прогоняет через жаберные щели воду, которая омывает жаберные лепестки, пронизанные капиллярами. Через их стенки растворенный в воде кислород переходит в кровь, а из крови в воду переходит углекислый газ.. Характерно, что для разных пород рыб нужно разное количество кислорода. Наименее требователен карась. Он выживает и в заиленных прудах, обедненных кислородом, где почти весь растворенный в воде кислород расходуется на окисление органических веществ. Из прудовых рыб самый привередливый в этом смысле карп. Ему нужно, чтобы концентрация кислорода в воде была не меньше 4 мг/л. Еще больше кислорода требуется рыбам, обитающим в реках, особенно горных, например, форели.
Учитель. А где реакции окисления протекают быстрее и интенсивнее – в воздухе или в чистом кислороде и почему?
Биолог 1. И снова мы вспоминаем роман Ж.. Верна, где описано воздействие чистого кислорода на живые организмы: «Едва посеянные семена мгновенно показывали свои зеленые головки и росли не по дням, а по часам. Кочаны капусты становились кустами, а грибы - зонтиками. Но, увы! Все эти растения быстро блекли и умирали, истощенные и обессиленные. То же происходило и с домашними животными, от дворового пса до свиньи в хлеву».
Учитель: Объясните этот отрывок. Прав ли Жюль Верн?
Биолог 1. Живые организмы приспособились в ходе эволюции к дыханию воздухом, а не чистым кислородом. В случае же дыхания чистым кислородом ускоряются окислительные процессы обмена веществ и человеческий организм быстрее «сгорает». Писатель в чем-то был прав.
Учитель: А теперь мы можем доказать, что кислород всемогущ. Слово нашим поэтам.
1. Вышли дети погулять,
Кислородом подышать.
Вот подходят к новостройке,
Видят: сварщик! Стойте, стойте,
Близко вы не подходите
Он волшебник. Поглядите,
Взял железа он листы
И сварил! Смотри! Ух, ты!
Кислород – сказали им.
Расскажите и другим.
2.На заводах в сильной печи
Пламя вспыхнуло навстречу,
Целым тоннам чугуна.
Что же это? Вот те на!
Побежал чугун ручьями,
Формы, формы заливает!
Кислород помог в печи
Превратить чугун в ручьи.
3.Красотища! Красота!
Вдруг взлетает вверх гора.
И отличнейшей руды
На земле лежат пласты.
Кислород помог взорвать
И руду из недр достать.
Ввысь рванулась вдруг ракета,
В небесах пропала где-то.
Космос взят! А кислород
В двигателе у нее живет.
4.Кислород и в медицине
Очень нужен, очень ценен.
Вьется летчик в высоту,
А пожарник весь в дыму.
Задохнуться он не может,
Кислород ему поможет.
Учитель. Все живые существа на Земле дышат кислородом. А как кислород попадает в организм человека?
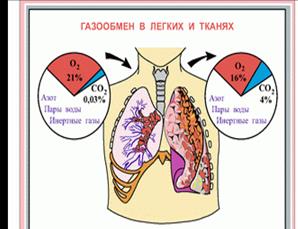
Рис.12 «Газообмен в легких человека»
Биолог. Человек дышит легкими. Кислород из воздуха проникает через мембраны легочных пузырьков в кровь, а СО2 – из крови в воздух.
Учитель. Как вы думаете, есть ли во Вселенной другие миры, кроме кислородного? В фантастической повести И.Ефремова «Сердце Змеи» рассказывается о встрече землян с представителями другого мира, не кислородного, а фторного. Может, и есть иные миры во Вселенной, нашу же колыбель - кислородный мир - мы должны любить и беречь от загрязнений. Что же загрязняет атмосферу? Слово предоставляется экологам.
Биолог . Загрязняют атмосферу транспорт, промышленные предприятия, тепловые электростанции. В состав выхлопных газов автомобилей входят оксиды C, N, S от каждой тысячи автомобилей за день в воздух поступает более 3000 кг оксида углерода (П) – очень токсичного вещества. ТЭЦ средней мощности, работающие на угле, только за один час сжигают более 80 тонн угля и выбрасывают в атмосферу примерно 5 тонн SO2 и 16-17 тонн золы.
Биолог. Промышленность выбрасывает в атмосферу значительное количество твердых частиц (сажа, зола, пыль, копоть) и вредных газов (SO2, CO2, CO, NO, NO2) образующиеся при неполном сгорании топлива, на котором работают предприятия. В 1 см3 городского воздуха содержится 100 тыс. пылинок. Промышленность всех стран мира выбрасывают в атмосферу 6 млрд. тонн CO2 ежегодно.
Эколог 3. Высокая концентрация оксидов серы обостряет хронические респираторные и сердечно - сосудистые заболевания, вызывает бронхиты, астму. Атмосферу необходимо охранять от загрязнения, бороться с загрязнением. Для этого надо правильно сжигать топливо, строить очистные сооружения, совершенствовать технологии производства и модернизацию транспорта, улучшать планировку городов и сел, расширять площади земных насаждений.
Учитель. Спасибо ребята за урок. Сегодня вы прекрасно подготовились к конференции, отлично работали и получаете хорошие оценки.
4 этап. Домашнее задание: индивидуальные творческие задания. Сочините стихи или песню о кислороде, изобразите в рисунках его использование и значение, придумайте загадки, шарады или ребусы о кислороде.
5 этап. Итог урока. Рефлексия.
Учитель: Продолжите фразу…..
-На этом уроке ………….
-Теперь я знаю…………
-Мне было интересно узнать, что химия нужна и ………………………
6 этап. Рефлексия.
Учитель: Понравился ли вам урок? Какое настроение после урока? Поднимите карточки, соответствующие оценке сегодняшнего урока и своему настроению.
Спасибо за вашу работу на уроке!
7 этап. Домашнее задание: §18,19, упр.1.2.3
Контрольная работа по химии 9 класс.
ПОДГРУППА КИСЛОРОДА.
Вариант 1.
ЧАСТЬ А. Тестовые задания с выбором ответа.
1. (2 балла). Электронная формула атома кислорода: А.1s22s22p4.
Б. 1s22s22p6. В. 1s22s22p63s23p4. Г. 1s22s22p63s23p6.
2. (2 балла). Формула вещества с ковалентной полярной связью:
А. CaO. Б. O2. В. H2O. Г. NaCl.
3. (2 балла). Ряд формул веществ, в котором степень окисления серы уменьшается: А. SO3 – FeS – SO2. Б. MgS – S – SO2. В. SO2 – S – H2S. Г. S – H2S – Al2S3.
4. (2 балла). Неметаллические свойства в ряду химических элементов O – S – Se – As: А. Изменяются периодически. Б. Не изменяются В. Ослабевают. Г. Усиливаются.
5.
![]() (2 балла). Сумма всех коэффициентов
в уравнении реакции, схема которой H2S + O2
SO2 + H2O: А. 4. Б. 6. В.
9. Г. 12.
(2 балла). Сумма всех коэффициентов
в уравнении реакции, схема которой H2S + O2
SO2 + H2O: А. 4. Б. 6. В.
9. Г. 12.
6. (2 балла). Уравнение реакции, в котором элемент сера является восстановителем: А. Fe + H2SO4 = FeSO4 + H2. Б. S + O2 = SO2.В. 2Li + S = Li2S. Г.SO3 + H2O = H2SO4.
7. (2 балла). Свойство, характерное для серы : А. Хорошо растворима в воде.
Б.Имеет металлический блеск.
В.Твёрдое вещество жёлтого цвета.
Г.Проводит электрический ток.
8. (2 балла). Массовая доля кислорода наименьшая в соединении с формулой:
А. K2O. Б. H2O. В. Li2O. Г. Na2O.
9. (2 балла). Оксид серы (VI) реагирует с веществом, формула которого:
А. H2SO4. Б. NaOH. В. SiO2. Г. Cu.
10. ![]()
![]() (2
балла). Сокращённое ионное уравнение реакции, соответствующее молекулярному H2SO4 + Zn = ZnSO4 + H2 : А. H+
+ OH- = H2O.
(2
балла). Сокращённое ионное уравнение реакции, соответствующее молекулярному H2SO4 + Zn = ZnSO4 + H2 : А. H+
+ OH- = H2O.
Б. SO3 + 2OH- = SO42- + H2O. В. 2H+ + Zn = Zn2+ + H2 . Г. Ba2+ + SO42- = BaSO4.
ЧАСТЬ Б. Задания со свободным ответом.
11. ![]()
![]()
![]()
![]() (8
баллов). Составьте молекулярные и ионные уравнения реакций для следующей схемы
превращений: SO2 1
H2SO3
2 Na2SO3
3 MgSO3.
(8
баллов). Составьте молекулярные и ионные уравнения реакций для следующей схемы
превращений: SO2 1
H2SO3
2 Na2SO3
3 MgSO3.
12. ![]() (8 баллов). Составьте уравнение
реакции, схема которой Cu + H2SO4(конц.) …+ SO2
+ H2O. Рассмотрите
её с точки зрения ОВР.
(8 баллов). Составьте уравнение
реакции, схема которой Cu + H2SO4(конц.) …+ SO2
+ H2O. Рассмотрите
её с точки зрения ОВР.
13. (2 балла). Дополните фразу: «Газометр служит для …».
14. (6 баллов). С помощью какого катиона можно распознать сульфат – ион? Составьте возможное уравнение реакции в молекулярном и ионном виде.
15. (6 баллов). По термохимическому уравнению реакции 2H2(г) + O2(г) = 2H2O(ж) +572 кДж рассчитайте объём водорода, необходимого для получения 1144 кДж.
Контрольная работа по химии 9 класс.
ПОДГРУППА КИСЛОРОДА.
Вариант 2.
ЧАСТЬ А. Тестовые задания с выбором ответа.
ЧАСТЬ Б. Задания со свободным ответом.
Рекомендации стандартов Ф ГОС
С целью реализации ФГОС Российской федерации обеспечить учебную
программу не одним часом в неделю , а минимум 3-мя часами.
Считаю, что ни одна отрасль промышленности не обходится без знаний
химии и продуктов химической технологии. Здоровье человека, экология
среды, научно-технический процесс и многое другое настолько зависимы в
современном мире от развития и знаний химии.
Ещё рекомендую учителям на уроках химии часто
использовать возможности ИКТ, составить презентации, вести модульную
систему контроля знаний и выполнения экспериментальных задач.
Это всё обеспечило бы возможности расширения, интенсификации процесса
достижения предметных, метапредметных и личностных результатов
соответственно стандартам ФГОС РФ.
Нам педагогам дана возможность перераспределения часов в тематическом
плане с учётом специфики учащихся, что очень важно.
Акцентировать большое внимание на выработку практических умений и
навыков по решению и выполнение экспериментальных и расчётных задач.
Заключение
Важнейшим фактором, обеспечивающим успешность ФГОС, является системность подготовки к введению ФГОС и комплексность всех видов сопровождения обеспечения ФГОС.
Важнейшим требованием к подготовке и обеспечению введения ФГОС является постоянное научное и методическое сопровождение, включая консультирование всех участников данного процесса. При введении ФГОС должна быть организована широкая разъяснительная работа среди педагогической и родительской общественности о целях и задачах ФГОС, его актуальности для системы образования, для обучающихся и их семей. При этом образовательные учреждения должны стать основными площадками проведения работы с общественностью, в первую очередь с родителями, по разъяснению необходимости введения ФГОС, его требований, механизмов введения, ожидаемых результатов.
Планируемый нами результат, а именно, повышение профессиональной компетентности педагога в реализации ФГОС на уроках химии в 9-ом классе был достигнут. Уверена, что полученные знания помогут нам в дальнейшей работе по внедрению стандартов нового поколения в процессе обучения химии по теме « Неметаллы». Сегодня важно не столько дать ребенку как можно больше конкретных предметных знаний и навыков в рамках отдельных дисциплин, а вооружить его такими универсальными способами действий( метапредметные навыки), которые помогут ему развиваться и самосовершенствоваться в непрерывном меняющемся обществе.
Список использованной литературы
1. Стандарты второго поколения. Примерные программы по предметам Химия 8-9 класс М: Просвещение, 2010.
2. Сборник нормативных документов. Химия / Сост. Э.Д.Днепров, А.Г.Аркадьев. – М.: Дрофа, 2004.
3. Габриелян О.С. Программа курса химии для 8 – 11 классов общеобразовательных учреждений – 3-е изд., стереотип. – М.: Дрофа, 2006.
4. Габриелян О.С. Химия. 9 класс: Учеб. для общеобразоват. учеб. заведений. – 14-е изд., стереотип. – М: Дрофа, 2008.
5. Габриелян О.С. Химия. 8 – 9 классы: Методическое пособие. – 4-е изд., стереотип. – М.: Дрофа, 2001
6. Габриелян О.С, Воскобойникова Н.П.,. Яшукова А.В., Настольная книга учителя химии» -9 класс, «Дрофа», Москва, 2007
7. Габриелян О.С., Смирнова Т.В. Изучаем химию в 8 классе: методическое пособие к учебнику Габриеляна О.С. «Химия-8» для учащихся и учителей. – М: «Блик и К0», 2001.
8. Гранкова А.Ю. Химия: 9 кл.: Метод пособие для учителя. – М.: ООО «Издательство АСТ», 2002.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.