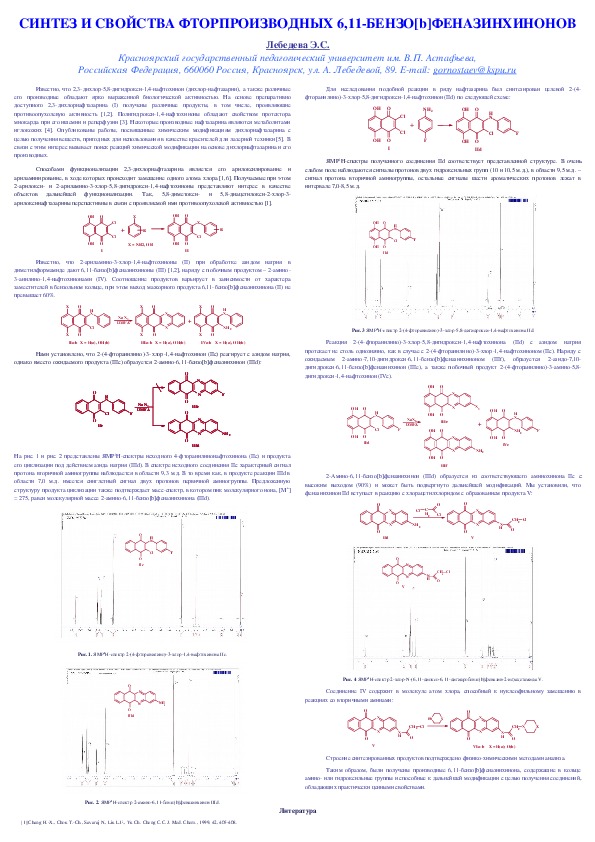
Способами функционализации 2,3-дихлорнафтазарина является его арилоксилирование и ариламинирование, в ходе которых происходит замещение одного атома хлора [1,6]. Получаемые при этом 2-арилокси- и 2-ариламино-3-хлор-5,8-дигидрокси-1,4-нафтохиноны представляют интерес в качестве объектов дальнейшей функционализации. Так, 5,8-диметокси- и 5,8-диацетилокси-2-хлор-3-арилоксинафтазарины перспективны в связи с проявляемой ими противоопухолевой активностью.
СИНТЕЗ И СВОЙСТВА ФТОРПРОИЗВОДНЫХ 6,11БЕНЗО[b]ФЕНАЗИНХИНОНОВ
Красноярский государственный педагогический университет им. В.П. Астафьева,
Российская Федерация, 660060 Россия, Красноярск, ул. А. Лебедевой, 89. Email: gornostaev@kspu.ru
Лебедева Э.С.
Известно, что 2,3дихлор5,8дигидрокси1,4нафтохинон (дихлорнафтазарин), а также различные
его производные обладают ярко выраженной биологической активностью. На основе препаративно
доступного 2,3дихлорнафтазарина (I) получены различные продукты, в том числе, проявляющие
противоопухолевую активность [1,2]. Полигидрокси1,4нафтохиноны обладают свойством протектора
миокарда при его ишемии и реперфузии [3]. Некоторые производные нафтазарина являются метаболитами
иглокожих [4]. Опубликованы работы, посвященные химическим модификациям дихлорнафтазарина с
целью получения веществ, пригодных для использования в качестве красителей для лазерной техники [5]. В
связи с этим интерес вызывает поиск реакций химической модификации на основе дихлорнафтазарина и его
производных.
Способами функционализации 2,3дихлорнафтазарина является его арилоксилирование и
ариламинирование, в ходе которых происходит замещение одного атома хлора [1,6]. Получаемые при этом
2арилокси и 2ариламино3хлор5,8дигидрокси1,4нафтохиноны представляют интерес в качестве
объектов дальнейшей функционализации.
5,8диметокси и 5,8диацетилокси2хлор3
арилоксинафтазарины перспективны в связи с проявляемой ими противоопухолевой активностью [1].
Так,
Для исследования подобной реакции в ряду нафтазарина был синтезирован целевой 2(4
фторанилино)3хлор5,8дигидрокси1,4нафтохинон (IId) по следующей схеме:
OH
O
OH
O
I
Cl
Cl
+
NH2
OH
O
F
OH
O
IId
H
N
Cl
F
ЯМР1Нспектры полученного соединения IId соответствует представленной структуре. В очень
слабом поле наблюдаются сигналы протонов двух гидроксильных групп (10 и 10,5 м.д.), в области 9,5 м.д. –
сигнал протона вторичной аминогруппы, остальные сигналы шести ароматических протонов лежат в
интервале 7,08,5 м.д.
OH
O
X
OH
O
Cl
Cl
+
R
X = NH2, OH
OH
O
I
OH
O
II
X
Cl
R
H
N
Cl
OH
O
OH
O
IId
F
Известно, что 2ариламино3хлор1,4нафтохиноны (II) при обработке азидом натрия в
диметилформамиде дают 6,11бензо[b]феназинхиноны (III) [1,2], наряду с побочным продуктом – 2амино
3анилино1,4нафтохинонами (IV). Соотношение продуктов варьирует в зависимости от характера
заместителей в бензольном кольце, при этом выход мажорного продукта 6,11бензо[b]феназинхинона (II) не
превышает 60%.
X
O
H
N
Cl
X
O
X
O
NaN3
DMFA
N
N
+
H
N
NH2
X
IIab
O
X = H(a), OH(b)
X
O
IIIab
X = H(a), OH(b)
O
X
IVab
X = H(a), OH(b)
Нами установлено, что 2(4фторанилино)3хлор1,4нафтохинон (IIc) реагирует с азидом натрия,
однако вместо ожидаемого продукта (IIIc) образуется 2амино6,11бензо[b]феназинхинон (IIId):
H
H
H
N
N
N
Cl
Cl
Cl
O
O
O
O
O
O
IIc
IIc
IIc
NaN3
NaN3
NaN3
DMFA
DMFA
DMFA
F
F
F
O
O
O
O
O
O
O
O
O
O
O
O
N
N
N
N
N
N
IIIc
IIIc
IIIc
N
N
N
N
N
N
IIId
IIId
IIId
F
F
F
NH2
NH2
NH2
На рис. 1 и рис. 2 представлены ЯМР1Нспектры исходного 4фторанилинонафтохинона (IIc) и продукта
его циклизации под действием азида натрия (IIId). В спектре исходного соединения IIc характерный сигнал
протона вторичной аминогруппы наблюдается в области 9,3 м.д. В то время как, в продукте реакции IIId в
области 7,0 м.д. имеется синглетный сигнал двух протонов первичной аминогруппы. Предложенную
структуру продукта циклизации также подтверждает массспектр, в котором пик молекулярного иона, [M +]
= 275, равен молекулярной массе 2амино6,11бензо[b]феназинхинона (IIId).
H
N
Cl
O
O
IIc
F
Рис. 1. ЯМР1Нспектр 2(4фторанилино)3хлор1,4нафтохинона IIc.
N
N
O
O
IIId
NH2
Рис. 3 ЯМР1Нспектр 2(4фторанилино)3хлор5,8дигидрокси1,4нафтохинона IId.
Реакция 2(4фторанилино)3хлор5,8дигидрокси1,4нафтохинона (IId) с азидом натрия
протекает не столь однозначно, как в случае с 2(4фторанилино)3хлор1,4нафтохиноном (IIc). Наряду с
ожидаемым 2амино7,10дигидрокси6,11бензо[b]феназинхиноном (IIIf), образуется 2азидо7,10
дигидрокси6,11бензо[b]феназинхинон (IIIе), а также побочный продукт 2(4фторанилино)3амино5,8
дигидрокси1,4нафтохинон (IVc).
H
N
Cl
OH
O
OH
O
IId
OH
O
NaN3
DMFA
F
OH
O
IIIe
OH
O
N
N
N
N
OH
O
IIIf
N3
+
NH2
OH
O
H
N
NH2
F
OH
O
IVc
2Амино6,11бензо[b]феназинхинон (IIId) образуется из соответствующего аминохинона IIс с
высоким выходом (90%) и может быть подвергнуто дальнейшей модификаций. Мы установили, что
феназинхинон IId вступает в реакцию с хлорацетилхлоридом с образованием продукта V:
O
O
N
N
IId
Cl
C
H2
O
Cl
NH2
N
N
O
O
V
N
H
CH2 Cl
O
O
O
N
N
V
N
H
CH2 Cl
O
Рис. 4 ЯМР1Нспектр 2хлорN(6,11диоксо6,11дигидробензо[b]феназин2ил)ацетамида V.
Соединение IV содержит в молекуле атом хлора, способный к нуклеофильному замещению в
реакциях со вторичными аминами:
O
O
N
N
V
NH
X
CH2 Cl
O
N
H
O
O
N
N
CH2
N
X
O
N
H
VIab
X = H(a); O(b)
Строение синтезированных продуктов подтверждено физикохимическими методами анализа.
Таким образом, были получены производные 6,11бензо[b]феназинхинона, содержащие в кольце
амино или гидроксильные группы и способные к дальнейшей модификации с целью получения соединений,
обладающих практически ценными свойствами.
Рис. 2. ЯМР1Нспектр 2амино6,11бензо[b]феназинхинон IIId.
Литература
[1] Chang H.X., Chou T.Ch., Savaraj N., Liu L.F., Yu Ch. Cheng C.C. J. Med. Chem., 1999, 42, 405408.[2] Huang L.J., Chang F.C., Lee K.H., Wang J.P., Teng C.M., Kuo S.C. Bioorgasnic&Medicinal Chemistry, 1998, 6, 22612269.
[3] Campbell C.A., Kloner R.A., Alker K.J., Braunwald E. J. Am. Cardiol, 1986, 8, 11691174.
[4] Thomson R.H. Naturally occurring quinones. 4th ed. L.; N.Y.: Blackie Acad. and Professional, 1997.
[5] Matsuoka M., Kim S.H., Kitao T. Journal of the Chemical Society, 1985, 17, 11951196.
[6] Nakazumi H., Kondo K., Kitao T. Synthesis, 1982, 10, 878879.
[7] J. A. VanAllan, G. A. Reynolds, R. E. Adel J. Org. Chem, 1962, 28, 520524.