
Тема « Общая характеристика элементов V -А группы»
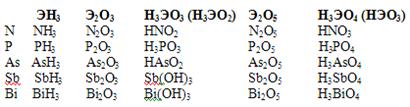
Главная подгруппа V группы периодической системы Д.И. Менделеева включает пять элементов: типичные p-элементы азот N, фосфор P, а также сходные с ними элементы больших периодов мышьяк As, сурьму Sb, и висмут Bi. Они имеют общее название пниктогены . Атомы этих элементов имеют на внешнем уровне по 5 электронов (конфигурация п s 2 п p 3 ).
В соединениях элементы проявляют степень окисления от -3 до 5. Наиболее характерны степени +3 и +5. Для висмута более характерна степень окисления +3.
При переходе от N к Bi радиус атома закономерно возрастает. С увеличением размеров атомов уменьшается энергия ионизации. Это значит, что связь электронов наружного энергетического уровня с ядром у атомов ослабевает, что приводит к ослаблению неметаллических и усилению металлических свойств в ряду от азота к Bi.
Азот и фосфор – типичные неметаллы, т.е. кислотообразователи. У мышьяка сильнее выражены неметаллические свойства. У сурьмы неметаллические и металлические свойства проявляются приближенно в одинаковой степени. Для висмута характерно преобладание металлических свойств.
Закономерно нарастает от N к Bi ионный радиус, но он много меньше атомного. Это связано с тем, что внешние электроны находятся на значительном расстоянии от ядра по сравнению с предвнешними, и когда атом теряет внешние электроны, переходит в ион, радиус иона соответственно ниже радиуса атома. Плотность закономерно нарастает.
Незакономерность изменения свойств (Tпл и Ткип ) обусловлена особенностью строения кристаллической решетки. Если азот – это газ, то последний элемент группы находится в твердом агрегатном состоянии.
В кристаллической решетке молекулы белого фосфора связаны межмолекулярными силами (силы Ван дер Ваальса), а так как они очень слабы, то белый фосфор легко распадается на молекулы под влиянием различных воздействий (температуры, растворителя). По этой причине он легко плавится при 44°С в бесцветную жидкость, при 275°С кипит.
Для элементов, не проявляющих металлических свойств стандартные электронные потенциалы отсутствуют.
Электронное строение внешних энергетических уровней атомов азота и фосфора следующие:
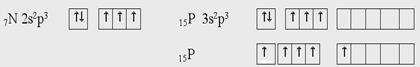
У атома азота три неспаренных электрона. Поэтому валентность азота равна трем. Из-за отсутствия у него d-подуровня на внешнем уровне его электроны разъединиться не могут. Однако в результате донорно-акцепторного взаимодействия азот становится четырехвалентным.
У атомов фосфора и последующих элементов VА группы имеются свободные орбитали на d-подуровне и переходя в возбужденное состояние будут разъединятся 3s-электроны. В невозбужденном состоянии у всех элементов 5А группы валентность равна 3, а в возбужденном состоянии всех, кроме азота, равна пяти.
Элементы этой группы образуют газообразные водородные соединения (гидриды) типа ЭН3 , в которых степень их окисления -3.
NH 3 аммиак
PH 3 фосфин
AsH 3 арсин
SbH 3 стибин
BiH 3 висмутин
AsH3 , SbH3 газы с неприятным запахом, легко разлагаются. Чрезвычайно ядовиты.
В кислородных соединениях для элементов VА группы наиболее характерны степени окисления +3 и +5. Для висмута более характерна степень окисления +3.
Все элементы VА группы имеют оксиды типа Э2 О5 и гидроксиды НЭО3 или Н3 ЭО4 , которые обладают кислотными свойствами. Кроме того для них характерны оксиды типа Э2 О3 и соответствующие гидроксиды НЭО2 или Н3 ЭО3 , у азота и фосфора они имеют кислотные свойства, у мышьяка и сурьмы – амфотерные, а у висмута проявляют основной характер.
Характерно также образование галидов типа ЭГ3 (тригалиды), которые (за исключением NF3 ) гидролизуются по схеме:
ЭГ3 + 3Н2 О = Н3 ЭО3 + 3НГ
Э Cl 3 + H 2 O = H 3 ЭО3 + 3Н Cl
но в присутствии галоводородной кислоты галиды сурьмы и висмута гидролизуются с образованием галоксидов, например
SbCl 3 + H 2 O = SbOCl + 2 HCl
Группу SbO+ называют антимонилом, а соединение SbOCl – хлоридом антимонила. Для фосфора, мышьяка и сурьмы известны пентафториды ЭF5 , а для фосфора и сурьмы пентахлориды ЭCl5 .
Мышьяк и сурьма имеют ряд аллотропных форм. Наиболее устойчивые металлические формы серого (As) и серебристо-белого (Sb) цвета. Это хрупкие вещества, легко превращаемые в порошок. Висмут – металл серебристо-белого цвета с едва заметным розовым оттенком.
Соединения As, Sb, Bi ядовиты. Особо опасны соединения As3+ ( AsH3 - арсин).
2. Химия азота
Азот (лат. nitrogenium) в свободном состоянии газ без цвета и запаха. Азот – основной компонент атмосферы Земли (78,09% по объему или 75,6% по массе, всего около 4·1015 т). Мы живем в азотной атмосфере, умеренно обогащенной кислородом и в малых количествах другими химическими элементами.
В космосе он занимает 4-е место вслед за водородом, гелием и кислородом. В живых организмах его до 0,3% в виде соединений. Растения, получая азот из почвы в виде минеральных солей, используют его для синтеза белков, витаминов и других жизненно важных веществ.
Азот относится к органогенам, наряду с углеродом, водородом и кислородом – элементы, которые чаще всего содержатся в органических веществах. Все важнейшие части клеток (протоплазма и ядро) построены из белковых веществ. Без белка нет жизни, а без азота нет белка.
Свободный азот несколько легче воздуха. Он плохо растворим в воде. Прочность молекулы азота велика. Даже при 3300°С только одна из тысяч молекул N2 распадается на атомы. Поэтому свободный азот в обычных условиях инертен к подавляющему большинству веществ. Для того чтобы азот вступил в химическую реакцию, требуется предварительная активация его молекул путем нагревания, облучения, действие катализатора или другими способами.
Из металлов свободный азот реагирует в обычных условиях только с литием, образуя нитрид:
6 Li + N 2 = 2 Li 3 N
С Na, Ca, Mg реакция идет только при нагревании. С кислородом азот взаимодействует только в электрической дуге (или при грозовом разряде в атмосфере):
N 2 + O 2 = 2 NO
С водородом реакция идет при нагревании (t ≈ 450-5000 С), под давлением и в присутствии катализатора
N 2 + 3 H 2 = 2 NH 3
Пропуская азот через раскаленный кокс можно получить (дициан) – соединение азота с углеродом N ≡ C — C ≡ N. С другими неметаллами кроме бора свободный азот не реагирует.
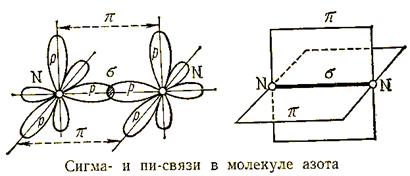
Причина инертности молекулярного азота – крайне прочная ковалентная неполярная связь. Два атома в молекуле удерживаются одной σ - связью и двумя π- связями. Т.е. связи в молекуле азота неравноценны. На разрушение молекулы азота на атомы затрачивается довольно большое количество энергии:
N 2 = 2 N ∆ H 0 = 946 кДж/моль
Строение молекулы N2
Получение N 2
В промышленности – сжижением воздуха с выделением фракций азота.
В лаборатории разложением нитрита аммония или азида натрия
NH4 NO2 = N2 + 2 H2 O
2 NaN3 = 3 N2 + 2 Na
или 2 NH 3 + 3 Br = N 2 + 6 HBr
Водородные соединения азота
С водородом азот образует два соединения: аммиак NH 3 и гидразин N 2 H 4 (H2 N – NH2 ). Наибольшее значение имеет аммиак.
В лаборатории получают слабым нагреванием смеси хлорида аммония с гидроксидом натрия:
NH 4 Cl + NaOH = NaCl + NH 3 + H 2 O
Основным промышленным способом получения аммиака является синтез его из азота и водорода
N 2 + 3 H 2 ↔ 2 NH 3 ∆ Н0 = - 82,4
( Катализатор Pt ; t = 450 - 5000 С; Р = 250 атм)
Равновесие обратимой реакции смещается вправо действием высокого давления ≈ 30МПа.
NH3 – бесцветный газ с резким характерным запахом, почти в 2 раза легче воздуха. Молекула NH3 поляризована – общие электронные пары сдвинуты к азоту. Кроме того, у атома азота остается неподеленной пара электронов. Это дополнительно увеличивает полярность и обуславливает многие свойства аммиака. Жидкий аммиак, подобно воде, хороший растворитель ионных соединений. Молекулы в жидком аммиаке ассоциированы за счет образования водородных связей.
Расположение связей в аммиаке тетраэдрическое, причем неподеленная пара электронов атома азота занимают одну из вершин тетраэдра.
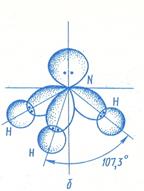
Аммиак – очень реакционно-способное вещество. Для него характерны реакции окисления и присоединения (благодаря неподеленной паре электронов). Наличие неподеленной пары определяет основные свойства аммиака, который может присоединять протон, образуя ион аммония NH 4 + .
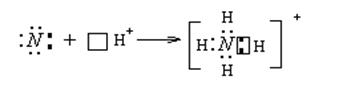
NH3 очень хорошо растворим в воде, но максимальная концентрация ω(NH3 )= 25%. В растворе имеют место равновесия:
NH3 + H2 O ↔ NH3 • H2 O NH3 • H2 O ↔ NH4 OH
NH4 OH ↔ NH4 + + OH– K д NH4OH = 1,8 • 10- 5
Основная масса NH3 в растворе находится в виде гидрата аммиака NH3 · H2 O. Поэтому, хотя NH4 OH диссоциирует почти нацело, его условно считают слабым основанием. Поскольку азот в NH3 имеет низкую степень окисления –3, аммиак является восстановителем в ряде реакций.
В кислороде аммиак горит без катализатора:
4 NH 3 + 3 O 2 = 2 N 2 + 6 H 2 O ,
а в присутствии катализатора платины
4 NH 3 + 5 O 2 = 4 NO + 6 H 2 O
При нейтрализации раствора аммиака кислотами образуются растворы солей аммония, содержащие ион NH4 + .
NH3 + HCl = NH4 Cl
NH3 + H2 SO4 = (NH4 )2 SO4
В этих реакциях ион аммония подобен ионам одновалентных металлов.
При замещении в молекуле аммиака 3-х атомов водорода получаются нитриды , содержащую группу N-3 , 2-х атомов водорода – имиды NН-2 , одного атома водорода - амиды NН2 - .
2 NH3 + 6Na = 2Na3 N +3H2 нитрид натрия
NH3 +2Na = Na2 HN + H2 имид натрия
2 NH3 +2Na = 2NaH2 N + 3H2 амид натрия
NH3 всегда - восстановитель, окисляется до N2 или NO.
t
CuO + NH 3 → Cu + N 2 + H 2 O
На этом свойстве основано применение NH3 и его солей в процессе пайки металлов – снятие оксидной пленки с поверхности.
CuO + NH4 Cl = Cu +N2 +HCl + H2 O
CuO + NH 4 Cl = Cu + CuCl 2 + H 2 O
Реагирует с более сильными окислителями
NH3 + KMnO4 + H2 SO4 → N2 + MnSO4 + K2 SO4 + H2 O
Аммиак участвует в реакциях комплексообразования, где NH3 является лигандом – донором электронов.
CuSO4 + 4NH3 = [Cu(NH3 )4 ]SO4 Кн = 10-13
Hg(NO2 )2 + 4NH3 = [Hg(NH3 )4 ](NO3 )2 Кн = 10-20
Водные растворы NH3 используют для получения гидроксидов металлов.
Fe 2 ( SO 4 )3 + NH 3 + H 2 O = Fe ( OH )3 ↓ + ( NH 4 )2 SO 4
Соли аммония все растворимы в воде, разлагаются при температуре различным образом
(NH4 )2 Cr2 O7 = Cr2 O3 + N2 + 4H2 O
NH4 NO2 = N2 + 2H2 O
NH4 NO3 = NO + 2H2 O
NH4 Cl = NH3 + HCl
Гидразин и гидроксиламин
Строение молекулы и характерные реакции: присоединения, окислительно-восстановительные. Соли гидразиния и гидроксиламмония.
Молекула гидразина N 2 H 4 достаточно устойчива, несмотря на эндотермичность ∆Н0 = 50,2 кДж/моль. Гидразин – жидкость.
![]()
При растворении в воде образует гидраты N2 H4 · H2 O и N2 H4 · 2H2 O
Соли гидразония – N2 H4 · HCl (N2 H5 Cl) ; N2 H4 · H2 SO4 (N2 H6 SO4 )
При взаимодействии с О2 выделяется большое количество тепла
N2 H4 + O2 = N2 + 2H2 O ∆H0 = – 621,5 кДж / моль
N2 H4 и его производные – сильные восстановители
N 2 H 4 + 2 I 2 = N 2 + 4 HI
при действии сильных восстановителей может быть окислителем, при нагревании диспропорционирует, проявляет окислительно – восстановительную двойственность.
N2 H4 + Zn + 4HCl = ZnCl2 + 2NH4 Cl
3N2 H4 = N2 + 4NH3
Для N2 H4 характерны реакции присоединения за счет донорно-акцепторного взаимодействия – входит во многие комплексные соединения в качестве лигандов, реагирует с H2 O, с кислотами, образуя соли аммония и гидразиния.
N2 H4 + H2 O = N2 H5 + + OH–
N2 H4 + HCl = [N2 H5 ]Cl
N2 H4 + 2HCl = [N2 H6 ]Cl2
N2 H4 + H2 SO4 = [N2 H6 ]SO4
ZnCl 2 + 2 N 2 H 4 = [ Zn ( N 2 H 4 )2 ] Cl 2
Гидразин более сильный восстановитель, чем NH3 и окисляется чаще всего до N2 .
5N2 H4 + 4KMnO4 + 6H2 SO4 = 5N2 + 4MnSO4 + 2K2 SO4 + 16H2 O
Гидроксиламин NH 2 OH , производное NH3 в котором один водорода при взаимодействии с водой дает гидрат гидроксиламина NH2 OH · H2 O.
Гидроксиламин NH2 OH – слабое основание за счёт азота, проявляет свойства донора электронной пары, участвует в реакциях присоединения.
NH2 OH +HCl = ( NH3 OH)Cl ( NH2 OH •HCl)
Соли гидроксиламина (NH3 OH)Cl, (NH3 OH)HSO4 - восстановители.
Для NH2 OH характерны свойства восстановителя и окислителя он может восстанавливаться до N2 , а также может окисляться до NH3 , NH4 + .
В щелочной среде наиболее характерны свойства восстановителя
NH2 OH + J2 + KOH = KJ + N2 + H2 O
NH2 OH + KMnO4 + H2 SO4 = N2 + MnSO4 + K2 SO4 + H2 O
В кислой среде чаще всего он восстановитель, но може быть и окислителем
NH2 OH +FeSO4 + H2 SO4 = (NH4 )2 SO4 + Fe2 (SO4 )2 + H2 O
![]() NH3
NH3
N2 H4 + KMnO4 + H2 SO4 = N2 + K2 SO4 + MnSO4 + H2 O
HN 3 ,
NH 2 OH
Получение: восстановление азотной кислоты атомарным водородом при электролизе раствора
HNO 3 + 6 H + + 6 e = NH 2 OH + H 2 O
При взаимодействии с HNO2 можно получить азотистоводородную кислоту HN 3 .
N 2 H 4 + HNO 2 = HN 3 + 2 H 2 O
HN3 – непрочная жидкость; ее соли (азиды) также непрочные соединения
Степень окисления азота в азид- ионе –1/3, а азидиона – 1.
На самом деле у азота
H – N -3 = N +5 ≡ N -3
[ :N– = N+ = N– :]–1 [ N ≡ N = N ]–1
· ·
· ·
2HN3 + 2Na = 2NaN3 +H2
2 NaN 3 = 2 Na + 3 N 2
Азотистоводородная кислота слабая (![]() = 10–5 ).
Соли азиды – растворимы в воде кроме азидов Ag (I), Pb (II)) Hg2+ ,
взрывчаты, за исключением солей щелочных металлов (взрывчат только LiN3 (азиды
меди и ртути взрываются при комнатной температуре).
= 10–5 ).
Соли азиды – растворимы в воде кроме азидов Ag (I), Pb (II)) Hg2+ ,
взрывчаты, за исключением солей щелочных металлов (взрывчат только LiN3 (азиды
меди и ртути взрываются при комнатной температуре).
HN3 – окислитель – смесь HN3 и HCl по окислительным свойствам аналогична царской водке, что обусловлено образованием атомарного хлора
4H2 + HN3 = 3NH3
HN3 + 2HCl = 2Cl + N2 + NH3
Сильными окислителями HN3 окисляется.
10HN3 + 2KMnO4 + 3H2 SO4 = 15N2 + 2MnSO4 + K2 SO4 + 8H2 O
2 N 3 – – 2 e = 3 N 2 º | 5
Mn +7 +5 e = Mn +2 | 2
Кислородные соединения азота
В кислородных соединениях азот проявляет степень окисления от +1 до +5.
N2 O ; NO ; N2 O3 ; NO2 ; N2 O4 ; N2 O5
Оксиды N2 O и NO – несолеобразующие, остальные солеобразующие.
Оксид азота (I) и оксид азота (II) – бесцветные газы, оксид азота (III) – синяя жидкость, (IV) – бурый газ, (V) – прозрачные бесцветные кристаллы.
Кроме N2 O, все они чрезвычайно ядовиты. Закись азота N2 O обладает весьма своеобразным физиологическим действием, за которые ее часто называют веселящим газом. Вот как описывают действия закиси азота английский химик Хэмфри Дэви, который с помощью этого газа устраивал специальные сеансы: «Одни джентльмены прыгали по столам и стульям, у других развязывались языки, третьи обнаружили чрезвычайную склонность к потасовке». Вдыхание N2 O вызывает потерю болевых ощущений и поэтому применяется в медицине как анестезирующее средство.
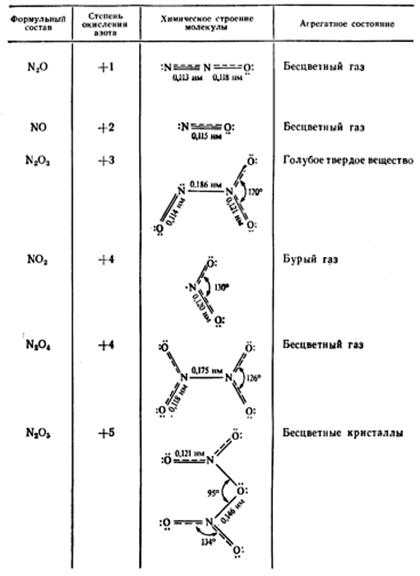
МВС предполагает в молекуле N 2 O наличие ионов N+ и N–
sp-гибридизация
|
↑ |
↑ |
↑ |
↑ |
+ N
|
↑↓ |
↑↓ |
↓ |
↓ |
– N
|
↑↓ |
↑↓ |
↓ |
↓ |
O
За счет sp-гибридизации ион N+ дает 2σ связи: одну с N– и другую с атомом кислорода. Эти связи направлены под углом 180º друг к другу и молекула N2 O линейна. Структуру молекулы определяет направленность σ связей. Оставшиеся у N+ два p-электрона образуют еще по одной π-связи: одну с ионом N– и другую с атомом кислорода. Отсюда N2 O имеет строение
σ σ
: N– = N+ = O :
· · · ·
Склонность NO2 к димеризации – следствие нечетного числа электронов в молекуле (парамагнитна).
С оксидами азота связаны серьезные экологические проблемы. Увеличение их концентрации в атмосфере приводит к образованию азотной кислоты и соответсвенно кислотных дождей.
N2 O3 взаимодействует с водой, образует неустойчивую азотистую кислоту HNO2 , которая существует только в разбавленных растворах, так как легко разлагается
2 HNO 2 = N 2 O 3 + H 2 O .
HNO2 может быть более сильным восстановителем, чем HNO3 , о чём свидетельствуют значения стандартных электродных потенциалов.
HNO 3 + 2 Н+ + 2е = HNO 2 + Н2 О Е0 = + 0,93 В
HNO2 + Н + + 1 е = NO + H2 O Е 0 = + 1,10 В
HNO 2 + 1 e = NO + H + Е0 = + 1,085 В
Ее соли нитриты – устойчивы. HNO2 - кислота средней силы (К ≈ 5 · 10–4 ). Наряду с кислотной диссоциацией в незначительной степени идет диссоциация с образованием NO+ и OH– .
Степень окисления азота в нитритах промежуточная (+3), поэтому в реакциях он может вести себя и как окислитель, и как восстановитель, т.е. обладает окислительно-восстановительной двойственностью.
Сильные окислители переводят NO2 – в NO3 – .
5NaNO2 + 2KMnO4 + 3H2 SO4 = 5NaNO3 + 2MnSO4 + K2 SO4 + 3H2 O
Сильные восстановители обычно восстанавливают HNO2 до NO.
2NaNO2 + 2KI + 2H2 SO4 = Na2 SO4 +2NO + I2 + K2 SO4 +2H2 O
Может происходить также процесс диспропорционирования, одновременного увеличения и уменьшения степени окисления атомов одного и того же элемента.
3 HNO 2 = HNO 3 + 2 NO + H 2 O
Нитриты обладают токсичностью: переводят гемоглобин в метгемоглобин, не способный переносить кислород и они служат причиной образования в продуктах питания нитрозааминов R2 N–NO – канцерогенных веществ.
Важнейшее соединение азота – HNO 3
Азотная кислота – важнейший продукт основной химической промышленности. Идет на приготовление взрывчатых веществ, лекарственных веществ, красителей, пластических масс, искусственных волокон и др. материалов.
HNO3 – бесцветная жидкость с резким удушливым запахом, дымящая на воздухе. В небольших количествах образуется при грозовых разрядах и присутствует в дождевой воде.
N2 + O2 → 2NO
2NO + O2 → 2NO2
4NO2 + O2 + 2H2 O → 4HNO3
Высококонцентрированная HNO3 имеет обычно бурую окраску вследствие происходящего на свету или при нагревании процесса разложения
4 HNO 3 = 4 NO 2 + 2 H 2 O + O 2
HNO3 – очень опасное вещество.
Важнейшее химическое свойство HNO3 состоит в том, что она является сильным окислителем и поэтому взаимодействует почти со всеми металлами кроме Au, Pt, Rh, Ir, Ti, Ta, металлы Al, Fe, Co, Ni и Cr она «пассивирует». Кислота же в зависимости от концентрации и активности металла может восстанавливаться до соединений:
+4 +3 +2 +1 0 -3 -3
NO2 → HNO2 → NO → N2 O → N2 → NH3 (NH4 NO3 )
и также образуется соль азотной кислоты.
Как правило, при взаимодействии азотной кислоты с металлами не происходит выделения водорода. При действии HNO3 на активные металлы может получаться водород. Однако атомарный водород в момент выделения обладает сильными восстановительными свойствами, а азотная кислота – сильный окислитель. Поэтому водород окисляется до воды.
Свойства концентрированной и разбавленной HNO 3
1) Действие концентрированной HNO3 на малоактивные металлы (Cu, Hg, Ag)
Cu + 4 HNO3 = Cu(NO3 )2 + 2NO2 ↑ + 2H2 O
2) Действие разбавленной HNO3 на малоактивные металлы
3Cu + 8 HNO3 = 3Cu(NO3 )2 + 2NO↑ + 4H2 O
3) Действие концентрированной кислоты на активные металлы
4Ca + 10HNO3 = 4Ca(NO3 )2 + N2 O↑ + 5H2 O
4) Действие разбавленной HNO3 на активные металлы
4Ca + 10 HNO3 = 4Ca(NO3 )2 + NH4 NO3 + 3H2 O
Одна из наиболее сильных кислот, характерны все реакции кислот: реагирует с основными оксидами, основаниями, амфотерными оксидами, амфотерными гидроксидами. Специфичное свойство – ярко выраженная окислительная. В зависимости от условий (концентрации, природы восстановителя, температуры) HNO3 может принимать от 1 до 8 электронов.
Ряд соединений N с различными степенями окисления:
NH3 ; N2 H4 ; NH2 OH ; N2 O ; NO ; N2 O3 ; NO2 ; N2 O5
NO3 – + 2H+ + 1e = NO2 + H2 O
NO3 – + 4H+ + 3e = NO + 2H2 O
2NO3 – +10H+ + 8e = N2 O + 5H2 O
2NO3 – +12H+ + 10e = N2 + 6H2 O
NO 3 – + 10 H + + 8 e = NH 4 – + 3 H 2 O
Образование продуктов зависит от концентрации, чем выше концентрация, тем менее глубоко она восстанавливается. Реагирует со всеми металлами, кроме Au, Pt, W. Концентрированная HNO3 не взаимодействует при обычных условиях с Fe, Cr, Al, которым она пассивирует, но при очень сильном нагревании реагирует с этими металлами.
Большинство неметаллов и сложных веществ восстанавливается HNO3 до NO (реже NO2 ).
3P + 5HNO3 + 2H2 O = 3H3 PO4 + 5NO
S + HNO3 = H2 SO4 + 2NO
3C + 4HNO3 = 3CO2 + 4NO + 2H2 O
ZnS + 8HNO3 k = ZnSO4 + 8NO2 + 4H2 O
6HCl + 2HNO3 k =3Cl2 + 2NO + 4H2 O
Запись окислительно-восстановительной реакции с участием HNO3 обычно условна, т.к. образуется смесь азотсодержащих соединений, а указывают тот продукт восстановления, который образовался в большем количестве.
Золото и платиновые металлы растворяются в «царской водке» – смеси 3 объемов концентрированной соляной кислоты и 1 объема концентрированной азотной кислоты, которая обладает сильнейшим окислительным свойством, растворяет «царя металлов» – золото.
Au + HNO3 +4HCl = H[AuCl4 ] + NO↑ + 2H2 O
HNO3 – сильная одноосновная кислота, образует только средние соли -нитраты, которые получают действием ее на металлы, оксиды, гидроксиды или карбонаты. Все нитраты хорошо растворимы в воде. Их растворы обладают незначительными окислительными свойствами.
При нагревании нитраты разлагаются; нитраты щелочных металлов превращаются в нитриты и выделяется кислород.
2 KNO 3 = 2 KNO 2 + O 2
Состав других продуктов зависит от положения металла в РСЭП.
Левее Mg = MeNO 2 + O 2 до магния
MeNO3 = Mg – Cu = MeO + NO2 + O2 правее магния.
правее Cu = Me + NO 2 + O 2 менее активных металлов
Нитраты аммония разлагаются
NH4 NO3 → N2 O + 2H2 O
NH4 NO3 → N2 + NO + H2 O
Нитриты не разлагаются, кроме NH4 NO2
NH 4 NO 2 → N 2 + 2 H 2 O
Получение азотной кислоты
t
В лабораторных условиях – KNO 3тв + H 2 SO 4 k = KHSO 4 + HNO 3 ↑
В промышленности: аммиачный или контактный способ.
Каталитическое окисление в контактном аппарате (катализатор – платинородиевые сетки)
t,k
1) 4NH3 + 5O2 → 4NO + 6H2 O
2) NO + O 2 → NO 2 при обычной t и повышенном P ≈ 600 – 1100 кПа
3) 4NO2 + O2 + H2 O → 4HNO3 ω (50 – 60%)
Соли азотной кислоты . Азотные удобрения
Нитраты – практически все хорошо растворимы в H2 O, поэтому природные месторождения редки. Основное количество получают искусственным путем на химических заводах, из HNO3 и гидроксидов.
Получают:
1) Взаимодействием с металлами, основаниями, амфотерными основаниями щелочами, нерастворимыми основаниями, аммиаком или его водным раствором, с некоторыми солями.
2) NO2 с растворами щелочей
2Ca(OH)2 + NO2 = Ca(NO3 )2 + Ca(NO2 )2 + 2H2 O
В кислой среде нитраты проявляют окислительные свойства подобно разбавленной HNO3
3FeCl2 + KNO3 + 4HCl = 3FeCl3 + KCl + NO↑ + H2 O
В щелочной окисляют активные металлы (Mg, Al, Zn)
4Zn + NaNO3 + 7NaOH + 6H2 O = 4Na2 [Zn(OH)4 ] + NH3 ↑
Наиболее сильные окислительные свойства нитраты проявляют при сплавлении
t
Cr2 O3 + 3NaNO3 + 4KOH = 3K2 CrO4 + 3NaNO2 + 2H2 O↑
Наиболее важные азотные удобрения:
Нитраты натрия, калия, аммония и кальция применяются главным образом как минеральные азотные удобрения и называются селитрами .
![]() NH 4 NO 3 ( NH 4 )2 SO 4 сульфат аммония
NH 4 NO 3 ( NH 4 )2 SO 4 сульфат аммония
KNO 3 селитры NH 3 • H 2 O аммиачная вода
NaNO 3 NH 4 H 2 PO 4 аммофос
Ca(NO3 )2 (NH4 )2 HPO4 диаммофос
CO ( NH 2 )2 мочевина, карбамид
Питательная ценность удобрения растворяется по ω(N) в нем.
В мочевине ω(N) = (2•14)/ (12 + 16 + 28 + 4)= 28/60 = 0,47 (47%).
В NH4 NO3 – азот в нитратной и аммиачной форме (35%), (NH4 )2 SO4 – наиболее ценное удобрение, так как азота больше всего в хорошо усвояемой форме.
К азотным удобрениям, как источникам азотного питания растений для повышения урожайности относят также органические удобрения (навоз, компост и др.), а также зеленые удобрения (люпин).
3. Химия фосфора
Фосфор (лат. Phosphorus) - один из наиболее распространенных элементов в земной коре. В свободном состоянии в природе не встречается из-за высокой химической активности. В связанном виде входит в состав около 200 минералов, главным образом апатитов 3Ca3 (PO4 )2 *CаХ2 (Х=Cl, F, OH)2 и фосфоритов Ca3 (PO4 )2 .
Известно 11 аллотропных модификаций
фосфора, наиболее изучен белый, красный и черный фосфор. Белый фосфор имеет
молекулярную формулу P4 и представляет правильный тетраэдр с
углом между связями в 60О . ![]()

Белый фосфор очень ядовит. Смертельная доза для человека составляет 0,15 г. Уже при комнатной температуре белый фосфор легко испаряется и его пары окисляются. Энергия этих реакций переходит частично в световую, что является причиной свечения белого фосфора в темноте.
Он легко загорается (возможно самовоспламенение). Обращаться с ним надо крайне осторожно. Хранить необходимо под водой.
Красный фосфор получают при длительном нагревании белого фосфора при температуре 280-340 О С под давлением и без доступа воздуха. Это темно-красное мелкокристаллическое мало-летучее вещество.
Содержание фосфора в человеческом организме составляет около 1 % от его массы.
280 - 340° С 200° С
Pбел → Ркрасн Pбел → Рчерн
Красный фосфор почти не ядовит и менее огнеопасен, чем белый. Самовозгорание не происходит, однако зажечь его легко и горение протекает очень бурно.
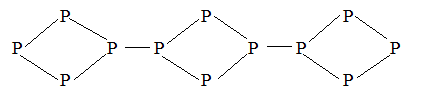
- в основе полимеры, получаются размыканием тетраэдра P4 .
Наиболее устойчивой формой фосфора является черный фосфор . По внешнему виду и свойствам напоминает графит, жирный на ощупь, разделяется на чешуйки, проводит электрический ток. Не ядовит, химически наименее малоактивен, воспламеняется только при температуре 490 О С.
Хотя фосфор является электронным аналогом азота, но наличие в валентном электронном слое атома свободных d - орбиталей делает соединения фосфора не похожими на соединения азота.
Различие между соединениями азота и фосфора связано с образованием донорно-акцепторных π-связей между атомами фосфора и донорами электронных пар, особенно кислородом. Поэтому при переходе от N к P прочность связей Э-Н вследствие увеличения размера атома снижается, однако связи Э-О значительно упрочнятся.
Образование донорно-акцепторных связей объясняет интенсивное взаимодействие фосфора с кислородом, устойчивость и многообразие кислородных соединений фосфора.
Наиболее устойчивая степень окисления +5. В этой степени окисления соединения фосфора не проявляют окислительные свойства из-за ее стабильности, в отличии от азота. Т.к. имеются свободные 3d – орбитали, то по сравнению с азотом валентных возможностей больше и максимальная валентность фосфора может быть 5, редко 6.
Получение:
1. Из фосфоритной муки сплавлением с углеродом и оксидом кремния
Ca3 (PO4 )2 + C +SiO2 → P4 + CaSiO3 + CO
2. Из фосфата Са, при температуре выше 1500о С
Ca3 (PO4 )2 + C → CaO + P4 + CO
Химические свойства :
P + O2 = P2 O3
P + O2 = P2 O5
P + S = P2 S3
P + Cl 2 = PCl 3
P + H 2 не идет
Реагирует с кислотами
P + HNO3 = H PO4 + NO + H2 O
P + H2 SO4 = H3 PO4 + SO2 + H2 O
Реагирует со щелочами
P + KOH + H2 O = KH 2 PO2 + PH3 ↑
Соединения: В отличие от азота фосфор непосредственно не реагирует с водородом. Гидрид фосфора (РН3 ) фосфин получают гидролизом фосфида кальция.
Са3 Р2 + 6Н2 О ® 3Са(ОН)2 + 2РН3 ↑
Фосфин – бесцветный ядовитый газ с запахом гнилой рыбы. Самовоспламеняется на воздухе
2РН3 + 4О2 ® P 2 O 5 + 2Н2 О
Мало растворим в воде и в отличие от NH3 не реагирует с ней.
С очень сильными бескислородными кислотами образует соли фосфония аналогично аммиаку.
РН3 + HI = PH 4 I
иодид фосфония
Дифосфин (аналог гидразина) (Р2 Н4 ) – представляет собой жидкость, самовоспламеняющуюся на воздухе.
Кислородные соединения фосфора
При недостатке воздуха или медленном окислении белого фосфора получают ядовитый фосфористый ангидрид Р2 О3 точнее (Р4 О6 ), а при избытке воздуха или в кислороде фосфорный ангидрид Р4 О10 .
4Р + 3О2 = 2Р2 О3
4Р + 5О2 = 2Р2 О5
в воде растворяется с образованием ортофоcфористой кислоты
Р2 О3 + 3 H 2 О = 2 H 3 РО3
Н2 [HPO3 ] 2-х основная средней силы
Н3 РО3 – фосфористая кислота, максимум двухосновная, т.к. атом водорода, связанный непосредственно с фосфором, не способен к замещению, ее изображают нередко формулой Н2 [НРО3 ] средней силы, соли – фосфиты.
2Н3 РО4 = Н4 Р2 О7 + Н2 0 К(Н4 Р2 О7 ) = 3*10-2
Фосфористый ангидрид белое кристаллическое вещество, очень ядовитое. На воздухе при нагревании он окисляется в оксид фосфора (V) – белые кристаллы.
Р2 О3 + О2 ® Р2 О5
Р2 О5 не может быть получен дегидратацией фосфорных кислот из-за высокой экзотермичности реакции его с водой. На этом основано применение Р2 О5 как осушителя, водоотнимающего средства, в этом отношении он превосходит все вещества. Он отнимает от сложных веществ даже связанную воду.
В зависимости от соотношения числа молекул воды и оксида фосфора (V) Р2 О5 образует несколько типов фосфорных кислот.
Р2 О5 + 3Н2 О = 2Н3 РО4 КН3РО4 =7,5*10-3 средней силы кислота
Ион РО4 3- имеет тетраэдрическую конфигурацию вследствие sp3 гибридизации атомных орбиталей.
При упаривании ортофосфорной кислоты образуется дифосфорная (пирофосфорная) кислота.
Дифосфорная кислота более сильная, чем ортофосфорная, она четырехосновная.
При недостатке воды образуется полимерная метафосфорная кислота, в виде стеклообразной массы, хорошо растворимой в воде.
n Р2 О5 + n Н2 О = 2 (НРО3 ) n К = 1,6*10-3
где n – от 3 до 8. средней силы
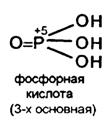
Из кислот в степени окисления +5 наибольшее применение находит ортофосфорная кислота. Она не ядовита и поэтому применяется в пищевой промышленности для приготовления сиропов. Поскольку она трехосновная, то образует средние и кислые соли.
Na3 PO4 – ортофосфат натрия, Na2 HPO4 - гидроортофосфат натрия, NaH2 PO4 – дигидроортофосфат натрия. Первичные фосфаты обычно хорошо растворимы в воде, почти все вторичные и третичные растворимы мало.
Соли фосфорной кислоты находят широкое применение в сельском хозяйстве как важнейшие минеральные удобрения, содержащие фосфор в связанном виде. Фосфор необходим для нормального развития растений. Фосфорные удобрения составляют половину всех производимых минеральных удобрений. Наиболее распространены:
Ca 3 ( PO 4 )2 – фосфоритная мука
Са(Н2 РО4 )2 + Са S О4 – простой суперфосфат
Са(Н2 РО4 ) – двойной суперфосфат
СаНРО4 - преципитат
NH 4 H 2 PO 4 , ( NH 4 )2 HPO 4 – аммофос, комбинированное удобрение.
Получение удобрений
Суперфосфат – эту смесь солей кальция получают обработкой фосфоритов или апатитов рассчитанным количеством технической серной кислоты.
Са3 (РО4 )2 + 2Н2 S О4 = Са(Н2 РО4 )2 + 2Са S О4 (Р2 О5 » 20%)
Полезная часть суперфосфата – растворимый в воде дигидрофосфат кальция, хорошо усваиваемый растениями. Сульфат кальция является балластом. Поэтому выгоднее получать двойной суперфосфат.
Для этого сначала получают фосфорную кислоту
Са3 (РО4 )2 + 3Н2 SO 4 = 3 CaSO 4 ↓ + 2 H 3 PO 4
а затем удобрения
Са3 (РО4 )2 + 4Н3 PO 4 = 3 Ca ( H 2 PO 4 )2 - концентрированное фосфорное удобрение.
Кроме суперфосфата хорошим фосфорным удобрением кислых почв служит преципитат . Его получают нейтрализацией фосфорной кислоты известью.
Н3 РО4 + Са(ОН)2 = СаНРО4 ↓ + 2Н2 О
гидрофосфат кальция нерастворим в воде, но растворяется в почвенных кислотах.
А ммофос – комбинированное удобрение, включает азот и фосфор.
NH 3 + H 3 PO 4 = NH 4 H 2 PO 4
2 NH 3 + H 3 PO 4 = ( NH 4 )2 HPO 4
Кислородсодержащие кислоты фосфора делят на 2 группы:
1) со связью Р-Н и 2) без нее.
Со связью Р-Н менее устойчивы (энергия Р-О > энергии связи Р-Н), поэтому легко окисляется кислородом.
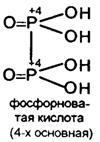
Фосфорноватистая Н3 Р+1 О2 – одноосновная , не имеющая ангидрида (довольно сильная К = 8,5*10-2 ).
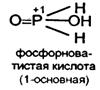
Соли – гипофосфиты – хорошо растворимы в Н2 О.
Гипофосфиты и Н3 РО2 – энергичные восстановители (особенно в кислой среде).
Ортофосфористая Н3 +3 РО3 – Н2 [ HPO 3 ] – двухосновная , образуется при взаимодействии Р4 О6 с холодной Н2 О. Это кристаллическое вещество, кислота средней силы К= 8·10-3 .
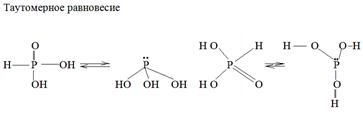
При нагревании Н3 РО3 диспропорционирует.
4Н3 РО3 ® 3Н3 РО4 + РН3
Пирофосфористая - Н4 Р2 О5 .
Фосфорноватая кислота Н4 Р2 О6 –четырехосновная, средней силы (К =6,1·10-3 ), ангидрид её не известен.
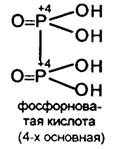
Известно соединение Р2 О4 , но оно при взаимодействии с Н2 О дает Н3 РО3 и Н3 РО4 , т.е. диспропорционирует подобно N2 O4
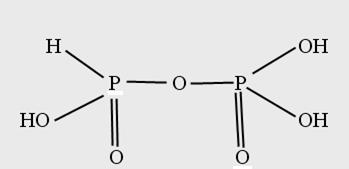
Фосфористофосфорная Н4 Р2 О6 - трехосновная тот же состав, что и фосфорноватая, но отличается строением.
3. Биогенная роль
Азот в живом веществе 3·10%, т.е. мы живем в азотной атмосфере, умеренно обогащенной кислородом и в очень малых количествах другими элементами.
Термин «азот» означает безжизненный. Это название он получил за свою инертность к реакциям с другими элементами. В то же время известно, что без азота трудно представить себе жизнь на земле и что азот и жизнь - понятия неотделимые.
В биосфере азот образуется при бактериальном брожении белковых веществ, а также в результате разложения азотсодержащих веществ, входящих в состав горных парод.
Характерно, что растения и животные потребляют не свободный, а связанный азот, находящийся в почве в форме азотнокислых и аммиачных солей.
Функции перевода свободного азота в связанный выполняют азотофиксирующие бактерии, которые, поглощая азот воздуха, используют его для синтеза белков и других органических соединений.
Азотные соединения, особенно нитраты, загрязняют биосферу, вредны для организма и могут быть причиной отравления человека. Азот в почве находится в форме недоступных растениям органических веществ, которые разлагаются бактериями на простые соединения NH3 , СО2 , Н2 О, соли. Процесс выделения аммиака называют аммонизацией. Аммиак с кислотами почвы образуют соли, усвояемые растениями.
Атмосферный азот фиксируется клубеньковыми бактериями, живущими на корнях бобовых растений. Эти бактерии усваивают азот воздуха, создают из него азотные вещества, используемые растениями для синтеза белков.
Фосфор – принадлежит к относительно распространенным элементам земной коры. Кларк его 8·10-2 %. Ферсман назвал его элементом жизни и мысли. В организме животных, растений и человека фосфора содержится от сотых-десятых до целых процентов. Наибольшее его количество концентрируется в костной ткани (у человека в костях содержится 5,05 %, в зубной эмали – 17 % фосфора). Относительно много фосфора в тканях мозга и мышцах. Фосфор в организмах обеспечивает энергетические процессы. При недостатке фосфора в организме (ниже 0,1 %) у животных развивается заболевания костей.
Мышьяк – в разных случаях и видах выступает как яд и как целительное средство. История дает немало случаев использования мышьяка в качестве яда для отравления противников. Симптомы мышьякового отравления –металлический вкус во рту, рвота, боли в животе: при сильном отравлении –судороги, паралич, смерть.
В то же время мышьяк ¾ важнейший компонент многих лекарств. В небольших количествах соли мышьяковой и мышьяковистой кислот улучшают питание животных, усиливают процессы ассимиляции и усвоения азота и фосфора.
На основе мышьяка страны НАТО изготавливают смертоносное оружие.
Ортоарсенаты используются в сельском хозяйстве как инсектициды.
Na2 НА sO4 , Na3 AsO4
CaH А sO4 , Са 3 (AsO4 )2
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.