
Задания для самоподготовки по теме: «Химические реакции кислот в растворах».
Задание: 1. Посмотреть видеолекцию =>
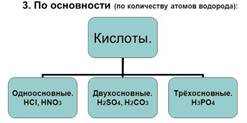
Кислоты - сложные вещества, состоящие из одного или нескольких атомов водорода, способных замещаться на атома металлов, и кислотных остатков. Число атомов водорода определяет основность кислот.
Повторяем формулы кислот)
|
Формула кислоты |
Название |
|
HCl |
хлороводородная, или соляная кислота |
|
HF |
фтороводородная, или плавиковая кислота |
|
HI |
иодоводородная кислота |
|
HBr |
бромоводородная кислота |
|
HNO2 |
азотистая кислота |
|
HNO3 |
азотная кислота |
|
H2S |
сероводородная кислота |
|
H2SO3 |
сернистая кислота |
|
H2SO4 |
серная кислота |
|
H2CO3 |
угольная кислота |
|
H2SiO3 |
кремниевая кислота |
|
H3PO4 |
фосфорная кислота |
|
CH3COOH |
уксусная кислота |
Классификация кислот:
1. По наличию кислорода в кислотном остатке:

|
HNO2, HNO3, H2SO3, H2SO4, H2CO3, H2SiO3, H3PO4 |
HCl, HF, HI, H2S |
2. Сила кислот:
сильными считаются:1) из бескислородных кислот - HCl, HBr, HI;
2) из кислородсодержащих – HNO3, H2SO4 HClO4
слабыми считаются: все остальные
Получение кислот
|
Кислородсодержащие |
1.Кислотный оксид+вода |
SO3+H2O=H2SO4 |
|
3.Cоль+менее летучая кислота |
NaNO3+H2SO4=HNO3 |
|
|
Бескислородные |
1.Водород+неметалл |
H2+Cl2=2HCl |
|
2.Cоль+менее летучая кислота |
2NaCl+H2SO4=2HCl |
Химические свойства
|
Кислородсодержащие |
Бескислородные |
|
1.Изменяют окраску индикаторов |
|
|
универсальный – красный, лакмус-красный, метилоранж-красный ( только для растворимых кислот) |
|
|
2.Взаимодействие с металлами, стоящими до водорода |
|
|
H2SO4+Ca=CaSO4+H2 |
2HCl+Ca=CaCl2+H2 |
|
2.Взаимодействие с основными оксидами |
|
|
H2SO4+CaO=CaSO4+H2O |
2HCl+CaO=CaCl2+H2O |
|
3.Взаимодействие с основаниями |
|
|
H2SO4+Ca(OH)2=CaSO4+2H2O |
2HCl+Ca(OH)2=CaCl2+2H2O |
|
4.Взаимодействие с амфотерными оксидами |
|
|
H2SO4+ZnO=ZnSO4+H2O |
2HCl+ZnO=ZnCl2+H2O |
|
5.Взаимодействие с солями, если образуется малорастворимое, летучее или малодиссоциирующее вещество |
|
|
H2SO4+BaCl2=BaSO4+2HCl |
2HCl+Na2CO3=2NaCl+H2O+CO2 |
|
6.При нагревании |
|
|
Слабые
кислоты легко разлагаются |
H2S=H2+S |
Задание 2. (устно) Приведи по два примера кислородсодержащих кислот, бескислородных кислот, сильных и слабых кислот, одноосновных и двухосновных кислот. Получается ли у вас устно перечислить с чем реагируют кислоты, и что при этом образуется?
Задание 3 выполняем
1. Из приведённых формул веществ ׃ H3PO4, Са(ОН) 2 , Н2S, СО2 , Н2СО3 , Na2O, NaOH, Fe2O3 , НNO2, HNO3 , SO3, НCl, Al(OH) 3 ,Н2SO4, К3PO4 выпишите формулы кислот и назовите их. Укажите одноосновные кислоты.

3. Решить тест =>
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.