
Тема урока: Расчёты по химическим уравнениям.
Задачи:
1. сформировать умения проводить расчеты по уравнениям химических реакций, оформлять решение задач, объяснять последовательность действий;
2. повторить понятия: «относительная молекулярная масса», «молярная масса», «химическое уравнение», «количество вещества»;
3. продолжить развитие и совершенствование умений записи химического уравнения и расчетов по формуле;
4. развивать логическое мышление, продолжить развитие умений работать в паре.
Мотивация и целеполагание:
Создание проблемной ситуации на экологическую тематику с акцентированием внимания на необходимость умения проводить расчеты массы, объёма, как основного, так и побочных продуктов (либо вредных выбросов) технологического процесса промышленных производств.
Изучение нового материала:
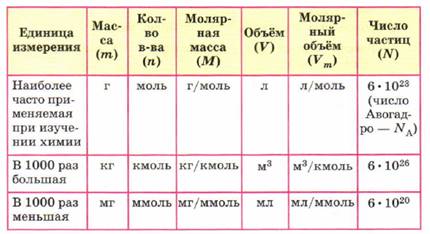
Составив уравнение химической реакции, можно рассчитать количество вещества, массу, объём реагирующих и образующихся веществ. Для этого нужно выбрать соответствующие друг другу единицы измерения массы, объёма и количества вещества (см. табл. 7).
Для решения задачи нужно использовать следующий алгоритм:
1. Составить уравнение химической реакции.
2. Перевести данные задачи, чтобы они соответствовали друг другу.
3. Над соответствующей формулой в уравнении записать найденное количество вещества, а количества над формулами искомых веществ обозначить через х и у.
4. Найти количества искомых веществ, учитывая, что они совпадают с коэффициентами.
5. Найти массу или объём через найденное количество вещества.
6. Оформить ответ.
Далее учащиеся рассматривают примеры решения задач 1-3 (см. 168-171).
Обобщение и систематизация знаний:
1. Учащиеся пересказывают друг другу ход решения задач по уравнениям.
2. §29, упр. 1.
Закрепление и контроль знаний:
1. Определите массу SO2, которая образуется при взаимодействии 2 моль серы с кислородом.
Ответ: S + O2 = SO2
n(SO2) = n(S) = 2 моль, M(SO2) = 32 + 32 = 64 г/моль, m(SO2) = 64 · 2 = 128 г.
2. Вычислите массу SO2, которая образуется при взаимодействии 64 г серы с кислородом.
Ответ: M(S) = 32 г/моль, n(S) = 64/32 = 2 моль, n(SO2) = n(S) = 2 моль, M(SO2) = 32 + 32 = 64 г/моль, m(SO2) = 64 · 2 = 128 г.
3. Составьте условие задачи, если известно, что вода разлагается под действием постоянного тока на водород и кислород.
Ответ: определите объём и массы газов, которые образуются при разложении воды, массой 1,8 г под действием постоянного электрического тока.
2H2O = 2H2 + O2
M(H2O) = 18 г/моль, n(H2O) = 1,8/18 = 0,1 моль, n(H2O) = n(H2) = 0,1 моль, M(H2) = 2 г/моль, m(H2) = 2 · 0,1 = 0,2 г, V(H2) = 22,4 · 0,1 = 2,24 л; n(O2) = 0,05 моль, M(O2) = 32 г/моль, m(O2) = 32 · 0,05 = 1,6 моль, V(O2) = 0,05 · 22,4 = 1,12 л.
4. Какая масса алюминия вступила в реакцию с кислородом, если образовалось 3,5 моль Al2O3?
5. Могут ли 2,68 г кислорода полностью прореагировать с 0,25 г водорода с образованием воды?
6. Какой объём водорода (н.у.) выделится при действии на цинк соляной кислоты, содержащей 10,95 г хлороводорода, если вторым продуктом реакции является хлорид цинка?
7. Какие массы соли и воды образуются при растворении оксида меди (II) в 300 г 9,8%-го раствора серной кислоты?
8. Какой объём воздуха (н.у.) потребуется для сжигания технической серы массой 150 г, содержащей 4% примесей? Продуктом реакции является оксид серы (IV). Объёмная доля кислорода в воздухе равна 21%.
Рефлексия и подведение итогов:
Как вы считаете, на каком уровне (высоком, среднем, низком) находится ваше умение решения задач по химическому уравнению исходя из изученного на уроке? Почему?
Домашнее задание:
I уровень: §29, упр. 2,3;
II уровень: тоже + упр. 4, 5.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.