
Урок № 22
Тема урока: Неметаллы. Общие физические и химические свойства неметаллов. Типичные свойства неметаллов IV– VII групп.
Цель занятия:
· Методическая:
- усовершенствовать методику актуализации опорных знаний
· Дидактическая:
- повторить с учащимися положение неметаллов в ПСХЭ, особенности строения их атомов;
- систематизировать и расширить знания о химических свойствах неметаллов;
- изучить особенности строения атомов неметаллов;
- изучить явление аллотропии на примере неметаллов;
- изучить физические свойства неметаллов;
- рассмотреть ЭО как меру «неметалличности»;
- рассмотреть относительность понятий «металл-неметалл»;
- изучить водородные соединения неметаллов.
· Воспитательная:
- достичь понимания важности изучения дисциплины;
- развивать аккуратность, внимательность, настойчивость при выполнении заданий;
- прививать интерес к предмету.
Вид занятия: комбинированное занятие.
Тип занятия: приобретение новых знаний.
Задание студентам :
1 Изучите теоретический материал.
2.Составить опорный конспект
3Ответить на контрольные вопросы
Теоретический материал
1.Физические и химические свойства неметаллов.
В противовес металлам существуют другие простые вещества, которые не обладают свойствами, характерными металлам. Эти вещества называют неметаллами. Неметаллы расположены в правом верхнем углу Периодической таблицы химических элементов по линии B-At (бор – астат).
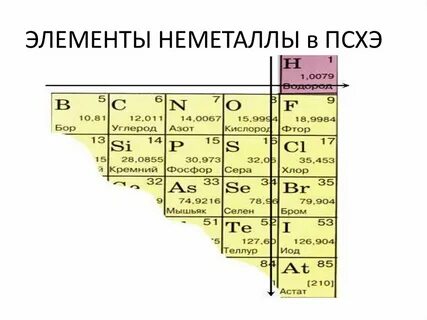
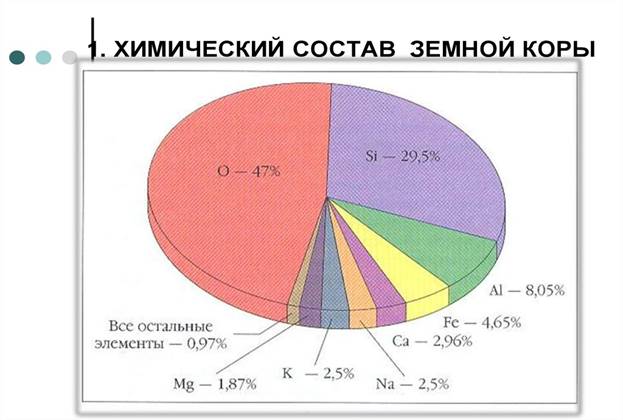
Из 118 химических элементов, известных на данный момент, 22 - это неметаллы, а 96 – это металлы. Они распространены в земной коре неравномерно. Так, например, кислород и кремний составляют 76,5% . Это, практически, три четверти от массы земной коры. Кислорода 47%, кремния 29,5%. В состав земной коры входят простые и сложные вещества, которые образованы элементами-неметаллами. На приведенной ниже диаграмме видны обозначения химических элементов и объемное содержание.
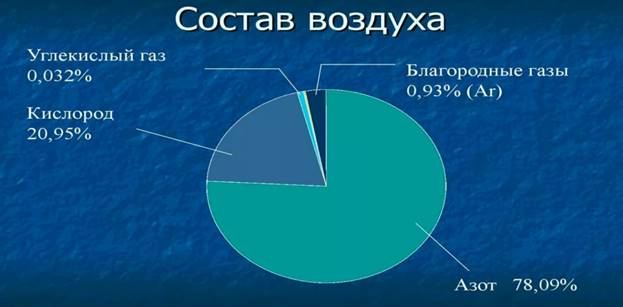
Воздух – основа жизни на Земле. Воздух состоит из неметаллов: на азот приходится 78,09%, на кислород – 20,95%, на аргон – 0,93% , остальные газ около 0,03%.
Элементы VIII группы – это инертные или благородные газы. Они занимают особое положение, так как имеют устойчивую внешнюю электронную оболочку и поэтому химически неактивны. Их формально относят к неметаллам по физическим признакам. Эти вещества сохраняют газообразное состояние до очень низких температур. Так, гелий переходит в жидкое состояние при -2690С. Инертность, в химическом отношении, у этих элементов относительная. Для ксенона и криптона известны соединения с фтором и кислородом. В этих соединениях инертные газы выступают в роли восстановителя.

Практически все неметаллы имеют сравнительно малые радиусы и большое число электронов на внешнем энергетическом уровне от 4 до 7.

Качественной характеристикой атомов неметаллов, то есть мерой их неметалличности может служить электроотрицательность. Это свойство элементов поляризовать химическую связь, оттягивать к себе общие электронные пары.

Электроотрицательность закономерно изменяется в периодах и подгруппах. Электроотрицательность химического элемента зависит от заряда ядра и радиуса атома. Чем меньше радиус атома, тем сильнее будут притягиваться к ядру внешние электроны, а значит больше значение элетроотрицательности. Самым электроотрицательным элементом является фтор, который находится на вершине правого верхнего угла Периодической системы. А вот водород занимает двойственное положение в таблице. Его относят к главным подгруппам I и VII групп. Это не случайно.
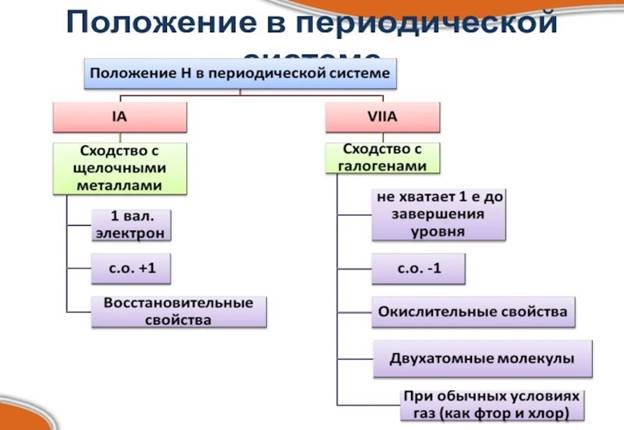
С одной стороны, атом водороды, подобно атомам щелочных металлов, имеет на внешнем электронном уровне один электрон, который он способен отдавать, проявляя свойства восстановителя и получая степень окисления +1. С другой стороны, атому водорода, как и галогенам, не достаёт одного электрона для завершения внешнего электронного уровня. Поэтому водород может принимать один электрон, проявляя свойства окислителя и характерную для галогенов степень окисления -1. При обычных условиях водород – газ, молекула которого, подобно галогенам, двухатомная.
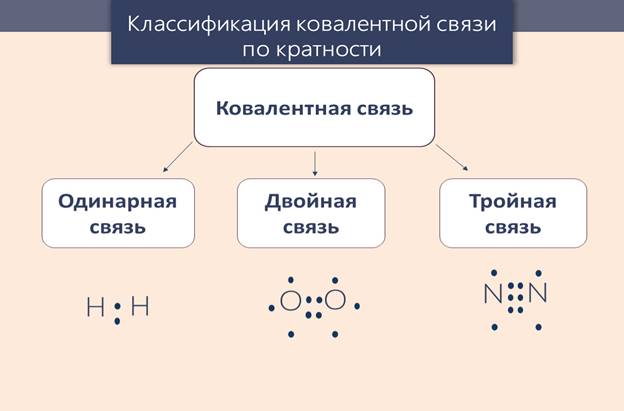
В простых веществах атомы неметаллов связаны ковалентной неполярной связью, благодаря этому формируется более устойчивая электронная система, чем у изолированных атомов. При этом образуются одинарные, двойные и тройные связи.
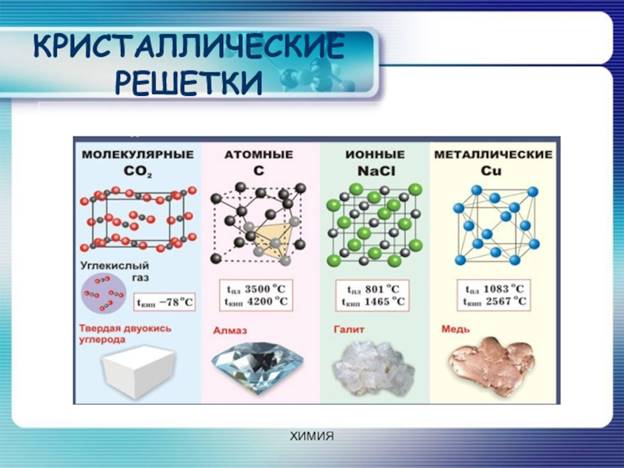
Кристаллические решётки металлов и твёрдых веществ неметаллов отличаются между собой. Атомы металлов образуют плотно упакованную кристаллическую структуру, в которой есть свободные электроны. В кристаллических решётках неметаллов, как правило, нет свободных электронов, поэтому твердые вещества неметаллы плохо проводят тепло и электрический ток, за исключением графита. Кристаллы неметаллов непластичны, хрупки и любая деформация вызывает разрушение ковалентных связей. Большинство неметаллов не имеют металлического блеска.
Физические свойства неметаллов
В отличие от металлов, неметаллы, простые вещества, характеризуются большим разнообразием свойств. Неметаллы имеют различное агрегатное состояние при обычных условиях.
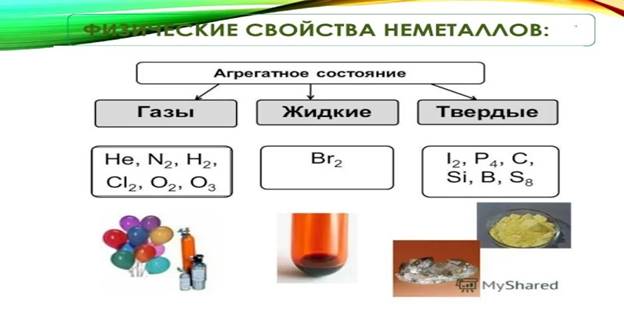
Газы – водород, кислород, озон, фтор, хлор, инертные газы; жидкость – бром;
твёрдые вещества – бор, углерод, кремний, фосфор, сера, мышьяк, селен, теллур, йод, астат.

Для простых веществ неметаллов гамма цветов значительно разнообразнее, чем у металлов.

Плотность различных неметаллов разнообразна. Самая маленькая у водорода, самая большая у радона. В воде неметаллы нерастворимы или мало растворимы. Некоторые неметаллы, как галогены и сера, лучше растворяются в органических растворителях, белый фосфор растворяется в сероуглероде.
Химические свойства неметаллов
Атомы неметаллов, а также простые вещества, образованные неметаллами, могут проявлять как окислительные, так и восстановительные свойства. Всё зависит от того, с какими веществами неметаллы вступают в реакцию.
Окислительные свойства неметаллов
1.1.Взаимодействие с неметаллами
2Na + S = Na2S
Реакция протекает при температуре выше 130 °C
3Mg + N2 → Mg3N2
Реакция идёт при пропускании сухого азота над магнием при температуре 780–800 °C
2Fe + 3Cl2 = 2FeCl3
1.2.Взаимодействие с водородом
H2 + S = H2S↑
Реакция идёт при нагревании
H2 + Cl2 → 2HCl↑
N2 + 3H2 ⇄ 2NH3↑
Процесс проводят при высоком давлении, высокой температуре и в присутствии катализатора
В результате таких реакций образуются летучие водородные соединения.
1.3.Взаимодействие с неметаллами, имеющими более низкую ЭО
Любой неметалл выступает в роли окислителя в реакциях с другими неметаллами, которые имеют более низкую электроотрицательность.
2P + 3S → P₂S₃
Реакция протекает при нагревании
Si + 2F2 → SiF4
Реакция протекает при обычных условиях
1.4. Взаимодействие с некоторыми сложными веществами.
2SO2 + O2 → 2SO3
2FeCl2 + Cl2 → 2FeCl3
2KI + Cl2 → 2KCl + I2
В последней реакции проявляется разная окислительная активность неметаллов. На этом основана способность одних неметаллов вытеснять другие из растворов их солей.
Восстановительные свойства неметаллов
1.5.Взаимодействие с фтором
O2 + 2F2 → 2OF2
Фтор — единственный из всех галогенов, который взаимодействует с кислородом, который в данной реакции является восстановителем.
3F2 + S = SF6
Реакция приводит к образованию гексафторида серы
1.6.Взаимодействие с кислородом
Все неметаллы (кроме фтора) в реакциях с кислородом являются восстановителями.
S + O2 → SO2↑
N2 + O2 ⇄ 2NO↑
Реакция азота с кислородом идёт только при температурах выше 2000°C или в электрическом разряде
4P + 5O2 → 2P2O5
Реакция протекает при температуре 240–400 °C
С + О2 = СО2↑
В результате таких реакций образуются оксиды неметаллов: несолеобразующие и солеобразующие кислотные.
1.7.Взаимодействие со сложными веществами-окислителями
CuO + H2 = Cu + H2О
В этой реакции водород восстанавливает медь из её оксида
6P + 5KClO3 = 3P2O5 + 5KCl
S + 6NaOH → Na2SO3 + 2Na2S + 3H2O
Последняя реакция называется реакцией диспропорционирования.В этой реакции сера является и окислителем и восстановителем. Сера со степенью окисления «0» восстанавливается до степени окисления «-2» и окисляется до степени окисления «+4».
Таким образом, большинство неметаллов могут выступать и в роли окислителя и в роли восстановителя. Восстановительная роль не присуща только фтору.
2.Способы получения неметаллов.
В свободном виде в природе встречаются благородные газы, кислород, азот, углерод, мышьяк, сера.

Часть неметаллов встречается в природе в виде
соединений, в которых атомы неметаллов проявляют только положительные степени
окисления. Это фосфор, кремний, бор и некоторые другие. Представители: 

апатит Ca3(PO4)2 фосфорит Ca5 (PO4)3(F, Cl) c примесью CaCO3.
Другая часть неметаллов представлена соединениями, в которых они проявляют отрицательные степени окисления



флюорит CaF2 галит NaCl сильвин KCl
Промышленные способы получения неметаллов можно разделить на три группы:
Ø выделение простых веществ из природных объектов;
Ø восстановление неметалоов, входящих в состав минералов;
Ø окисление природных соединений.
Воздух – ценное химическое сырьё, из которого получают азот, кислород, благородные газы, так как объёмная доля азота в воздухе составляет 78%, кислорода – 20,8%, аргона – 0,9%. Оставшиеся 0,3% приходятся на остальные компоненты: углекислый газ, гелий, неон и другие.
Задача разделения смеси газов решается фракционной перегонкой (ректификацией) жидкого воздуха, разделения его на фракции – компоненты.
Кристаллическая сера образует в земной коре мощные пласты. Если она расположена в поверхностном слое, её добывают открытым способом. Залегающую глубоко под землей, расплавляют перегретым паром и в жидком виде выдавливают на поверхность.
Нагреванием каменного угля без доступа воздуха получают кокс практически чистый углерод.
Фосфор получают восстановлением коксом из фосфоритов и апатитов
Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 2P + 5CO↑
Кремний получают восстановлением его коксом из оксида.
SiO2 + 2C = Si + 2CO↑
Наиболее активные неметаллы получают при помощи электрического тока – электролизом. Реакцию разложения электролита под действием электрического тока называют электролизом. Путём электролиза получают активные неметаллы: галогены, водород, кислород.
Хлор получают в промышленности с помощью электролиза. В качестве сырья используют доступную и дешёвую соль – хлорид натрия, а точнее раствор хлорида натрия.
2Н2О +2NaCl ![]() 2NaОН + Cl2↑ + Н2↑
2NaОН + Cl2↑ + Н2↑
3.Применение неметаллов.
Биологическая роль элементов-неметаллов
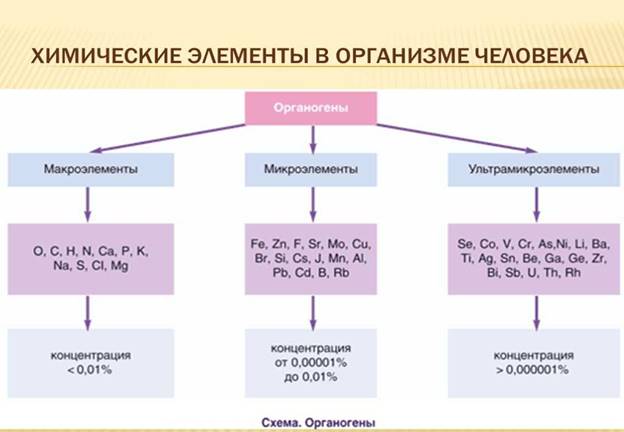
Биологическая роль химических элементов в организме человека чрезвычайно важна и разнообразна. Основу живых систем составляют только шесть элементов: углерод, водород, кислород, азот, фосфор, сера. Эти элементы, необходимые для построения и жизнедеятельности различных клеток и организмов, называют «биогенными элементами» и все эти элементы относятся к неметаллам. На долю перечисленных неметаллов в организме человека приходится 97,4%. Для этих элементов характерным является тоя. Что они способны образовывать разнообразные связи. Этим и обуславливается большое число молекул, существующих в живых организмах. Кроме того, углерод, водород, кислород, азот, фосфор, сера относятся к макроэлементам, т.е. элементам, содержание которых в организме выше 10-2 %.
К элементам, которые относятся к микроэлементам, содержание в организме от 10-3 до 10-5 %. К ним относятся йод, мышьяк, фтор, бром. К жизненно необходимым элементам относятся металлы – кальций, калий, магний и неметаллы - водород, кислород, азот, фосфор, сера, хлор, йод, углерод. Их дефицит приводит к нарушению нормальной жизнедеятельности человека. Для организма вреден не только недостаток , но и избыток биогенных элементов.
Поскольку свойства неметаллов чрезвычайно разнообразны, эти вещества находят широкое применение в различных областях народного хозяйства.
|
Область применения |
Примеры |
|
Промышленность |
Сера, азот, фосфор, хлор используются в качестве сырья для получения кислот и других химических продуктов. Сера используется в качестве сырья в производстве резины. Сажа (углерод) служит пигментом в производстве лаков и красок, а также пигментом и наполнителем в производстве пластмасс и резины. |
|
Транспорт |
Водород используется в качестве топлива. Продукт сгорания этого топлива не загрязняет окружающую среду. |
|
Сельское хозяйство |
Сера используется как эффективное средство борьбы с вредителями и болезнями растений. |
|
Медицина |
Кислород применяют когда у больного затруднено дыхание. Активированный уголь и спиртовой раствор йода есть во всех аптечках. Сера входит в состав мазей, которые используются при лечении кожных заболеваний. Жидкий азот используют для хранения биологического материала и в косметической медицине. |
|
Подготовка воды |
Для дезинфекции воды используют хлор и озон. |
|
Получение высоких температур |
В металлургии и металлообработке для того, чтобы, сжигая горючее вещество, создать среду с высокой температурой используют кислород. |
|
Пиротехника |
В производстве спичек и другой пиротехнической продукции используют серу, фосфор, уголь. |
|
Пищевая промышленность |
Для продления срока годности пищевых продуктов и создания инертной атмосферы в упаковку закачивается азот. |
Контрольные вопросы
1)Вставьте слова, пропущенные в тексте.
Атомы ____ в отличие от атомов ____ легко принимают наружные электроны, являются ____
2)Неметаллические свойства элементов с увеличением порядкового номера в периодах ____
3)В группах неметаллические свойства элементов ____
4)Пользуясь периодической таблицей, запишите молекулярные формулы высших кислородных соединений неметаллов III периода. Как будет изменяться кислотный характер?
5)Запишите формулы водородных соединений элементов VII А группы. Как изменяются кислотные свойства с увеличением порядкового номера элемента?
6)Водород занимает в периодической таблице два места: в I А группе и в VII А группе. Запишите молекулярные формулы водородных соединений Na, K, Cl, F.
7)Наиболее электроотрицательными являются атомы…..
• серы • фосфора • кремния • хлора
8)Типичному неметаллу соответствует следующая схема распределения электронов по электронным слоям:
2, 1
2, 8, 2
2, 8, 7
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.